题目内容
【题目】在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
A.混合气体的压强B.混合气体的平均相对分子质量
C.A的物质的量D.B的物质的量浓度
【答案】A
【解析】
A. 恒温、恒容时,体系的压强与气体分子的物质的量有关系,该化学反应前后气体的总物质的量不变,则反应的任何时候,混合气体的压强始终不变,故无法通过压强不变来判断反应是否达到平衡状态,A正确;
B. ![]() ,该平衡的正反应是气体质量增大的反应,当反应达到平衡时,气体的总质量不再改变,由于气体的总物质的量不变,所以平衡时,混合气体的平均相对分子质量不变,则混合气体的平均相对分子质量不变,表明反应达到平衡状态,B错误;
,该平衡的正反应是气体质量增大的反应,当反应达到平衡时,气体的总质量不再改变,由于气体的总物质的量不变,所以平衡时,混合气体的平均相对分子质量不变,则混合气体的平均相对分子质量不变,表明反应达到平衡状态,B错误;
C. A的物质的量不再变化,可以表明该反应已达到平衡状态,C错误;
D. 在恒容状态下,B的物质的量浓度不变,则B的物质的量也不再变化,可以表明该反应已达到平衡状态,D错误;
故合理选项为A。

【题目】回答下列问题:
(1)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
![]()
在上述由SiCl4(g)制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___。
(2)利用水煤气合成二甲醚的总反应为:3CO(g)+3H2(g) = CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ·mol-1,它可以分为两步,反应分别如下:2CO(g)+4H2(g) = CH3OCH3(g)+H2O(g) ΔH1=-205.1 kJ·mol-1,CO(g)+H2O(g) = CO2(g)+H2(g) ΔH2=_____。已知CH3OCH3(g)的燃烧热为1455 kJ·mol-1,写出表示其燃烧热的热化学方程式:__________。
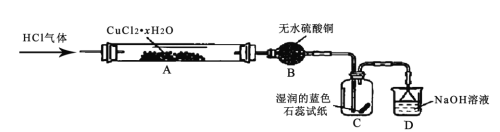
(3)用O2将HCl转化为Cl2,可提高效益,减少污染。一定条件下测得反应过程中 c(Cl2)的数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3 mol/L | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0 min内HCl的反应速率为_____。
(4)在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥c(I2):c(H2):c(HI)=1:1:2,⑦氢气的百分含量。能说明I2(g)+H2(g) ![]() 2HI(g)达到平衡状态的是____。
2HI(g)达到平衡状态的是____。
(5)在恒温恒压、不做功时,反应A+B = C+D一定能自发进行的条件是ΔH__0且ΔS___0(填“<”、“>”或“=”)。