题目内容
【题目】氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系: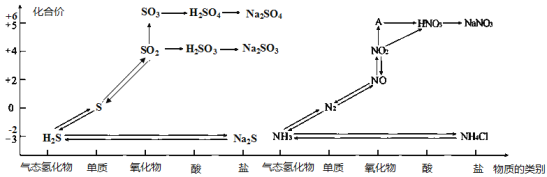
(1)根据A对应的化合价和物质类别,A为___________(写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有____________。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择________,反应的离子方程式为______________。
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:
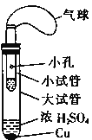
①写出制取SO2的化学方程式:_______________。
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为_____。
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式_______。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为____________。
【答案】N2O5 NO、NO2 浓硝酸 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O B NO+NO2+2NaOH=2NaNO2+H2O SO2+Br2+2H2O=H2SO4+2HBr
CuSO4+SO2↑+2H2O B NO+NO2+2NaOH=2NaNO2+H2O SO2+Br2+2H2O=H2SO4+2HBr
【解析】
(1)依据图中化合价与元素化合物之间关系可知A为+5价氧化物;所含元素化合价处于中间价态的既有氧化性又有还原性;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,铁与浓硝酸常温下发生钝化;
(3)①铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
②依据二氧化硫能使酸性高锰酸钾溶液褪色检验二氧化硫的还原性;
(4)NaOH与NO、NO2会发生归中反应产生NaNO2H2O,据此书写反应方程式;
(5)二氧化硫与溴水反应生成溴化氢和硫酸。
(1)依据图中化合价与元素化合物之间关系可知A为+5价的氮元素的氧化物,为N2O5;N原子最外层有5个电子,最高为+5价,最低为-3价,NO、NO2中氮元素处于中间价态,化合价既可以升高,又可以降低,所以NO、NO2既有氧化性又有还原性;
(2)铜与浓硝酸反应生成硝酸铜、NO2和水,铁与浓硝酸在常温下会发生钝化,所以可用浓硝酸除去铁制品表面的铜镀层,反应的离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(3)①在实验室中,一般是用铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
②二氧化硫的具有还原性,能够使酸性KMnO4溶液紫色褪色,所以检验SO2的还原性可选酸性高锰酸钾溶液,故合理选项是B;
(4)NO、NO2是大气污染物,可用NaOH溶液进行尾气处理,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O;
(5)二氧化硫与溴水反应生成溴化氢和硫酸,化学方程式:SO2+Br2+2H2O=H2SO4+2HBr。