题目内容
【题目】常温下,取一定量的PbI2固体配成饱和溶液 ,T时刻改变某一条件,离子的浓度变化如图所示,(注:第一次平衡时c(I-)=2x10-3mol/L, c(Pb2+)=1x10-3mol/L)下列有关说法正确的是

A.常温下,Ksp=2x10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,c(Pb2+)不变
C.T时刻改变的条件是升高温度,PbI2的,Ksp 增大
D.常温下Ksp[PbS]=8x10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5x1018
PbS(s)+2I-(aq)反应的化学平衡常数为5x1018
【答案】D
【解析】
试题A、PbI2(s)![]() Pb2+(aq)+2I-(aq),Ksp=[c(Pb2+]×[c(I-)]2=1×10-3×4×10-6=4×10-9,错误;B、PbI2(s)
Pb2+(aq)+2I-(aq),Ksp=[c(Pb2+]×[c(I-)]2=1×10-3×4×10-6=4×10-9,错误;B、PbI2(s)![]() Pb2+(aq)+2I-(aq),加入硝酸铅浓溶液,反应向逆反应方向进行,PbI2的溶解度降低,错误;C、T时刻升高温度,根据图像c(I-)是降低,说明反应向逆反应方向进行,溶解度降低,错误;D、K=c2(I-)/c(S2-)=
Pb2+(aq)+2I-(aq),加入硝酸铅浓溶液,反应向逆反应方向进行,PbI2的溶解度降低,错误;C、T时刻升高温度,根据图像c(I-)是降低,说明反应向逆反应方向进行,溶解度降低,错误;D、K=c2(I-)/c(S2-)= 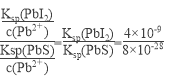 =5×1018A,正确。
=5×1018A,正确。

练习册系列答案
相关题目

