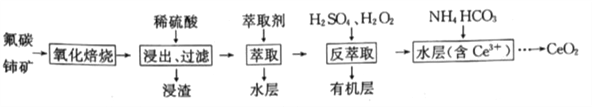
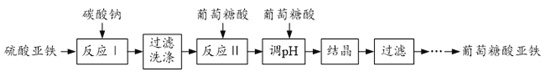
题目内容
【题目】对于反应:2H2S+SO2=3S+2H2O,氧化剂与还原剂的物质的量之比为
A.1:1B.2:1C.3:1D.1:2
【答案】D
【解析】
反应2H2S+SO2═3S+2H2O中,H2S中S元素化合价由-2价升高为0价,H2S是还原剂;SO2中S元素化合价由+4价降低为0价,SO2是氧化剂,所以氧化剂与还原剂的物质的量之比等于1:2,D满足题意。
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示。
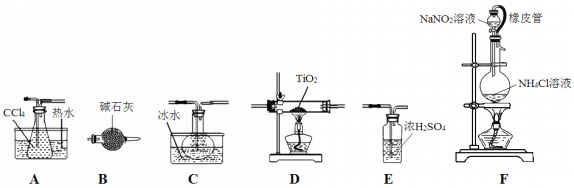
有关信息如下:
①反应原理:TiO2(s)+CCl4(g) △ T iCl4(g)+CO2(g)。
②反应条件:无水无氧且加热。
③有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它 |
CCl4 | 23 | 76 | 与TiCl4互溶 |
TiCl4 | 25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F橡皮管的作用是_________________________________________,装置F中有氮气生成,该反应的化学方程式为__________________________________________。
(2)实验装置依次连接的顺序为F→B→_____→_____→_____→_____。________________
(3)欲分离C中的液态混合物,所采用操作的名称是_____________。
(4)实验开始前首先点燃____处酒精灯(填“D或F”),目的是___________________。
(5)E装置______(填“能或不能”)换成B装置,理由是________________________。
【题目】某些物质的有关数据如下表,回答以下问题:
熔点(℃) | 沸点(℃) | 水溶性 | Ka1 | Ka2 | |||
乙醇 | -114.1 | 78.3 | 易溶 | 乙醇 | 2.6×10-16 | ||
乙醛 | -121 | 20.8 | 易溶 | H2SO3 | 1.23×10-2 | 5.6×10-8 | |
乙酸乙酯 | -83 | 77.0 | 难容 | H2CO3 | 4.2×10-7 | 5.6×10-11 |
实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是______________,解释该现象的化学反应方程式为____________;
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知:CH3CHO+NaHSO3![]()
![]() (a-羟基乙磺酸钠)
(a-羟基乙磺酸钠)
(2)写出Na2CO3溶液参与反应的化学方程式:________________;
(3)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。
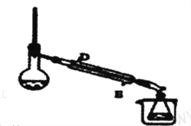
①冷凝管中的液体应从_____口进。(填“D”或“E”)
②下列有关操作与装置的分析,正确的是_____。(填字母)
a.烧杯中应装冰水 b.冷凝管应通温水 c.图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
实验试管 | pH | ||
第一次 | 第二次 | 第三次 | |
A | 12.42 | 12.40 | 12.38 |
b | 10.43 | 10.43 | 10.40 |
(4)试管a中乙醛溶液的物质的量浓度为___mol/L。(列出计算式即可)