题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土化合物,汽车尾气用稀土/钯三效催化剂处理,不仅可以降低催化剂的成本,还可以提高催化效能。以氟碳铈矿(主要成分为CeCO3F)为原料制备CeO2的一种工艺流程如下:
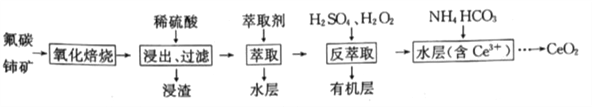
已知i.Ce4+能与F-结合成CeFx(4-x)+,也能与SO42-结合成(CeSO4)2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取:Ce4++n(HA)2![]() CeH2n-4A2n)+4H+,而Ce3+则不能。
CeH2n-4A2n)+4H+,而Ce3+则不能。
回答下列问题:
(1)CeCO3F中铈元素的化合价为_____,“氧化焙烧”过程中可以加快反应速率的方法是_____(答出两点即可)。
(2)“萃取”时,选用(HA)2作为萃取剂,(HA)2需满足的条件是________;“萃取”后的水层中含有的主要阴离子是________。
(3)“反萃取”时加入H2SO4的作用是__________;加入H2O2的作用是_______(结合离子方程式说明)
(4)浸渣经处理可得Ce(BF4)3,在KCl溶液中加入Ce(BF4)3,发生如下反应:Ce(BF4)3(s)+3K+(aq)![]() 3KBF4(s)+Ce3+(aq)
3KBF4(s)+Ce3+(aq)
一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,若上述反应体系中K+的物质的量浓度为cmol/L,则Ce3+的物质的量浓度为______mol/L。
【答案】 +3 将矿石粉碎,增大接触面积;提高焙烧温度;增大氧气(或空气)浓度 (HA)2不溶于水,且与水不反应 F-、SO42- 增大平衡体系Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+中c(H+),同时SO42-与Ce4+结合生成(CeSO4)2+,促使平衡逆向移动,有利于“反萃取”的进行[或:增大平衡体系(CeSO4)2++n(HA)2
Ce(H2n-4A2n)+4H+中c(H+),同时SO42-与Ce4+结合生成(CeSO4)2+,促使平衡逆向移动,有利于“反萃取”的进行[或:增大平衡体系(CeSO4)2++n(HA)2![]() Ce(H2n-4A2n)+4H++ SO42-中c(H+)和c(SO42-),促使平衡逆向移动,有利于“反萃取”的进行] 将+4价铈还原成+3价铈:2(CeSO4)2++H2O2=2Ce3++2SO42-+2H++O2↑(或2Ce4++H2O2=2Ce3++2H++O2↑),Ce3+不能被萃取,有利于Ce3+进入水层而分离 ac3/b3
Ce(H2n-4A2n)+4H++ SO42-中c(H+)和c(SO42-),促使平衡逆向移动,有利于“反萃取”的进行] 将+4价铈还原成+3价铈:2(CeSO4)2++H2O2=2Ce3++2SO42-+2H++O2↑(或2Ce4++H2O2=2Ce3++2H++O2↑),Ce3+不能被萃取,有利于Ce3+进入水层而分离 ac3/b3
【解析】(1)CeCO3F中C元素+4价,O元素-2价,F元素-1价,根据化合价代数和为零的原则,得出铈元素的化合价为+3价;“氧化焙烧”过程中加快反应速率的方法有:将将矿石粉碎,增大接触面积;适当提高焙烧温度;增大氧气(或空气)浓度;
(2)利用溶质在两种互不相溶的溶剂中溶解度不同,使一种溶质从一种溶剂内转移到另外一种溶剂中的过程,选用(HA)2作为萃取剂,(HA)2需满足的条件是:(HA)2不溶于水,且与水不反应,Ce4+易溶于(HA)2;氧化焙烧过程中CO32-生成CO2气体,所以“萃取”后的水层中含有的主要阴离子是:F-、SO42-;
(3)根据信息:Ce4+能与SO42-结合成(CeSO4)2+,在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,发生如下反应 (CeSO4)2++n(HA)2![]() Ce(H2n-4A2n)+4H++ SO42-,该反应是可逆反应,
Ce(H2n-4A2n)+4H++ SO42-,该反应是可逆反应,
所以,加入H2SO4,c(H+)和c(SO42-)都增加,促使平衡逆向移动,有利于“反萃取”的进行,因此:“反萃取”时加入H2SO4的作用是:促使平衡逆向移动,有利于“反萃取”的进行;加入H2SO4以后,Ce4+的离子浓度增大,题干中需要Ce3+,加入H2O2可以将+4价铈还原成+3价铈,即:2Ce4++H2O2=2Ce3++2H++O2↑,根据信息:在硫酸体系中Ce3+不能被(HA)2萃取进入有机层,有利于Ce3+进入水层而分离,所以加入H2O2的作用是:将+4价铈还原成+3价铈Ce3+不能被萃取,有利于Ce3+进入水层而分离;
(4)Ce(BF4)3、KBF4的Ksp表达式分别是:Ksp[Ce(BF4)3]=C(Ce3+)·C3(BF4-)=a,Ksp[KBF4]=C(K+)·C(BF4-)=b,C(K+)=cmol/L,C(BF4-)=b/c, C(Ce3+)=ac3/b3