题目内容
(1)32Ge原子核外电子有 种不同的运动状态,原子核外电子排布式为 。
(2)写出氮原子的核外电子的轨道表示式 。
(3)写出CCl4的电子式 ,其中心原子的杂化方式 。
(1)32 1s22s22p63s23p63d104s24p2;
(2)1s 2s
2s 2p
2p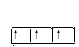
(3)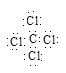 sp3杂化
sp3杂化
解析试题分析:(1)电子的运动状态是由电子层数、电子亚层、原子轨道、自旋方向所决定的,所以任何一个原子里不存在运动状态相同的两个电子,所以核外有多少电子,就有多少种运动状态,32Ge原子核外电子有32种不同的运动状态,原子核外电子排布式为1s22s22p63s23p63d104s24p2;
(2)氮原子的核外电子的轨道表示式1s 2s
2s 2p
2p
(3)根据电子式的书写原则,CCl4的电子式为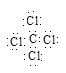 , CCl4的空间构型是正四面体,其中心原子的杂化方式sp3杂化。
, CCl4的空间构型是正四面体,其中心原子的杂化方式sp3杂化。
考点:考查原子结构中核外电子的排布,中心原子的杂化方式的判断

 名校课堂系列答案
名校课堂系列答案(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。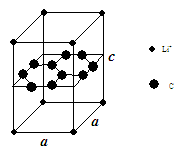
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
写出BeCO3分解的化学方程式 。
分解温度为什么越来越高? 。
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | | | | | | | |
| 二 | | | | ② | | ③ | ④ | |
| 三 | ⑤ | | ⑥ | ⑦ | ⑧ | | ⑨ | |
(1)在标号元素中,最活泼的金属元素是 。最活泼的非金属元素是 。⑨元素的离子结构示意图是 。
(2)①与②形成共价化合物的电子式 。用电子式表示⑤与⑨形成化合物的形成过程 。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是 。
(4)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是 。
⑦、⑧、⑨三种元素的最高价含氧酸的酸性由强到弱的顺序 。
(5)写出⑥元素的单质与盐酸反应的离子方程式: 。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是______(填编号)。
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物的浓溶液在加热条件下的反应:____________________;
②H2C2与EC2反应:_____________________________________________ 。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是________(写分子式)。比元素B原子序数大5的元素基态原子电子排布式是__________________。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中E元素原子以____________和__________杂化成键,分子中共形成____________个σ键,__________个π键。
(5)C和I相比较,非金属性较弱的是________(填元素名称),可以验证你的结论的是下列中的________(填编号)。
a.气态氢化物的稳定性和挥发性
b.单质分子中的键能
c.两元素的电负性
d.含氧酸的酸性
e.氢化物中X—H键的键长(X代表C和I两元素)
f.两单质在自然界的存在
 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0