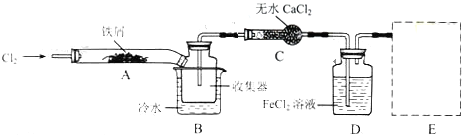
题目内容
12.W、X、Y、Z是原子序数1~18的元素,它们的原子核外电子层数相同且原子序数依次增大,W、X是金属元素,Y、Z是非金属元素.(1)W、X各自的最高价氧化物的水化物可以发生反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
(2)Y的低价氧化物通入Z单质的水溶液中发生反应生成两种强酸,反应的化学方程式为SO2+Cl2+2H2O═H2SO4+2HCl.
(3)比较Y、Z气态氢化物的稳定性HCl>H2S(用化学式表示);除了可以通过比较Y、Z气态氢化物的稳定性来验证Y、Z的非金属性外,请你再设计一个简单的实验,来验证Y与Z的非金属性强弱在Na2S的溶液中通入Cl2,若溶液变浑浊,证明Cl的非金属性强于S,反应方程式为Na2S+Cl2═S↓+2NaCl
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:S2->Cl->Na+>Al3+.
分析 W、X、Y、Z是原子序数1~18的元素,它们的原子核外电子层数相同,为同一周期元素,且原子序数依次增大,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的氧化物对应的水化物可以反应生成盐和水,可推知W为Na、X为Al;
(2)Y的低价氧化物通入Z单质的水溶液中发生反应生成两种强酸,则Y为S元素,Z为Cl元素,该反应为二氧化硫与氯气反应生成硫酸与HCl;
(3)非金属性越强,对应氢化物越稳定;可以利用单质之间相互置换反应等进行验证;
(4)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大.
解答 解:W、X、Y、Z是原子序数1~18的元素,它们的原子核外电子层数相同,为同一周期元素,且原子序数依次增大,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的氧化物对应的水化物可以反应生成盐和水,可推知W为Na、X为Al,该反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(2)Y的低价氧化物通入Z单质的水溶液中发生反应生成两种强酸,则Y为S元素,Z为Cl元素,该反应为二氧化硫与氯气反应生成硫酸与HCl,反应方程式为:SO2+Cl2+2H2O═H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O═H2SO4+2HCl;
(3)非金属性Cl>S,非金属性越强,对应氢化物越稳定,故氢化物稳定性:HCl>H2S,可以利用单质之间相互置换反应等进行验证,具体实验方案为:在Na2S的溶液中通入Cl2,若溶液变浑浊,证明Cl的非金属性强于S,反应方程式为Na2S+Cl2═S↓+2NaCl,
故答案为:HCl>H2S;在Na2S的溶液中通入Cl2,若溶液变浑浊,证明Cl的非金属性强于S,反应方程式为Na2S+Cl2═S↓+2NaCl;
(4)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->Na+>Al3+,
故答案为:S2->Cl->Na+>Al3+.
点评 本题考查结构性质位置关系应用,涉及方程式书写、元素化合物性质、元素周期律应用、微粒半径比较等,难度不大,注意掌握离子半径比较规律,掌握金属性、非金属强弱比较实验事实.

| A. | 在Fe+Cu2+=Fe2++Cu的反应中Fe作还原剂,在Fe于其他物质反应中Fe一定也作还原剂 | |
| B. | 在上述反应中,氧化性:Fe2+>Cu2+ | |
| C. | 金属活动性顺序表中,排在前面的金属阳离子氧化性强于排在后面的金属阳离子 | |
| D. | SO42-中的硫原子化合价是+6价,处于硫的最高价,因此SO42-氧化性一定很强 |
①加成 ②氧化 ③酯化 ④加聚 ⑤取代⑥水解.
| A. | 只有①②③ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 全部 |
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 乙二醇 | -11.5℃ | 198℃ | 1.11g•cm-3 | 易溶于水和乙醇 |
| 丙三醇 | 17.9℃ | 290℃ | 1.26g•cm-3 | 跟水、酒精任意比互溶 |
| A. | 萃取法 | B. | 结晶法 | C. | 分液法 | D. | 蒸馏法 |
| 容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
| Ⅱ | 607 | 0.22 | 0.82 | / | |
| Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10-3 |
| A. | 该反应正反应为放热反应 | |
| B. | 607K时该反应的平衡常数为2.50×10-3 | |
| C. | 容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动 |
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 | |
| D. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 |