题目内容
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
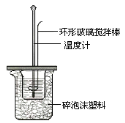
(1)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏 大、偏小、无影响”)
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由__
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
【答案】偏小 不相等 相等 因中和热是指稀酸与稀碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关 偏小
【解析】
中和热测定实验成败的关键是保温工作,反应放出的热量和所用酸以及碱的量的多少有关。
(1)中和热测定实验成败的关键是保温工作,大烧杯上如不盖硬纸板,热量损失较多,测定的热量的值偏小,所以求得的中和热数值偏小,故答案为:偏小;
(2)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的物质的量增多,所放出的热量增多,但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,中和热数值相等,即不变,故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;
(3)NH3H2O电离过程中会吸热,所以相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小,故答案为:偏小。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
a | b | ||||||||||||||||
c | d | ||||||||||||||||
e | f | g | h | i | |||||||||||||
j | k | l | m | ||||||||||||||
(1)画出k元素的原子结构示意图______________________________。
(2)写出j元素的原子核外电子排布式___________________________。
(3)写出l元素的+1价阳离子核外电子排布式___________________________。
(4)写出m元素的原子外围电子排布式___________________________,m元素位于周期表中___________周期_________族_________区。
(5)原子半径大小e___________d,第一电离能大小关系是g___________h,电负性大小关系是c___________d(以上填“>”或 “<”)。
【题目】在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g) ![]() CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则

(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | C1 | C2 | C3 | C3 |
4 | C1 | C2 | C3 | C3 |
5 | 0.116 | 0.216 | 0.084 | C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 .增大了CO2浓度 d.增加了氢气浓度





