题目内容
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

【答案】1s22s22p3 1 +1 大 4 sp2 共价 ![]() ×100%
×100%
【解析】
(1)根据N、Ga的原子序数,结合原子构造原理分析解答;
(2)根据电离能差值分析元素的化合价,电离能差值过大说明失去该电子较困难,同周期元素随着原子序数增大,电负性增强,同主族元素随着原子序数增大,电负性增强;根据同一周期元素的电负性变化规律分析比较;
(3)一个Ga与4个O相连,据此判断配位数;
(4)利用价层电子对互斥模型判断原子杂化方式;
(5)GaAs为原子晶体,原子间以共价键结合;利用均摊法计算一个晶胞中含有的As、Ga原子数,通过计算晶胞体积、晶胞中As、Ga的总体积就可计算出原子的体积占晶胞体积的百分率。
(1)N是7号元素,核外电子排布式是1s22s22p3,Ga是31号元素,位于第四周期第IIIA,核外电子排布式是[Ar]3d104s24p1,应用一个轨道最多可容纳2个自旋方向相反的电子,所以在3d、4s轨道上电子成对,只有4p电子是成单电子,故Ga原子核外有1个未成对电子;
(2)根据Ga失去电子的逐级电离能数值,第一电离能和第二电离能差值较大,且第三电离能和第四电离能数值差别较大,说明失去第二个电子和失去第四个电子较困难,所以呈现的价态是+1和+3;Ga、As是同一周期的元素,一般情况下,同一周期的元素,原子序数越大,元素的非金属性越强,其电负性越大,所有电负性As>Ga;
(3)一个Ga与4个O相连,所以Ga的配位数为4;
(4) (CH3)3Ga中Ga形成3个δ键,没有孤电子对,所有Ga原子的杂化方式为sp2杂化;
(5) GaAs为原子晶体,原子间以共价键结合;利用均摊法计算一个晶胞中含有的As、Ga原子数,As:8×![]() +6×
+6×![]() =4,Ga:4×1=4,即一个晶胞中含有4个GaAs;由于晶胞的密度为ρg·cm-3,晶胞的质量m=
=4,Ga:4×1=4,即一个晶胞中含有4个GaAs;由于晶胞的密度为ρg·cm-3,晶胞的质量m=![]() g,所以晶胞的体积V=
g,所以晶胞的体积V=![]() cm3;4个Ga原子的体积为V(Ga)=
cm3;4个Ga原子的体积为V(Ga)=![]() cm3;4个As原子的体积为V(As)=
cm3;4个As原子的体积为V(As)=![]() cm3;所以GaAs晶胞中原子的体积占晶胞体积的百分率为
cm3;所以GaAs晶胞中原子的体积占晶胞体积的百分率为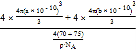 ×100%=
×100%=![]() ×100%。
×100%。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=_____________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正)___v(逆) (填“>” “=” “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____,CO的平衡转化率=____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂