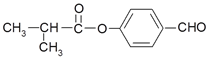
题目内容
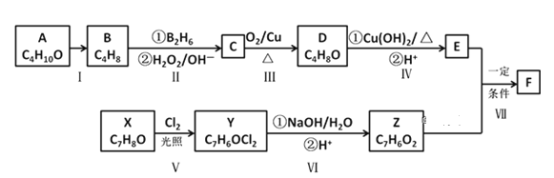
【题目】铝热反应原理可以应用在生产上,如用于焊接钢轨等,实验室铝热反应的实验装置如图所示。
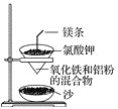
(1)镁条的作用是___。
(2)写出该反应的化学方程式:___;在冶金工业上也常用这一反应原理来冶炼__(填字母)。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(3)为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
①若取ag样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为bL。反应的离子方程式是___;样品中铝的质量为___g。
②另取ag样品将其点燃,恰好完全反应,反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与(1)中所得气体的体积比c∶b=__。
【答案】利用镁条燃烧放出的热量促使氧化铁和铝发生剧烈反应 2Al+Fe2O3![]() 2Fe+Al2O3 D 2Al+2OH-+2H2O=2AlO2-+3H2↑
2Fe+Al2O3 D 2Al+2OH-+2H2O=2AlO2-+3H2↑ ![]() 2∶3
2∶3
【解析】
(1)镁条的作用是利用镁条燃烧放出的热量促使氧化铁和铝发生剧烈反应。故答案为:利用镁条燃烧放出的热量促使氧化铁和铝发生剧烈反应。
(2)铝热反应,铝与氧化铁反应生成三氧化二铝和铁,该反应的化学方程式:2Al+Fe2O3![]() 2Fe+Al2O3;在冶金工业上也常用这一反应原理来冶炼高熔点金属,故选D。故答案为:2Al+Fe2O3
2Fe+Al2O3;在冶金工业上也常用这一反应原理来冶炼高熔点金属,故选D。故答案为:2Al+Fe2O3![]() 2Fe+Al2O3;D;
2Fe+Al2O3;D;
(3)①铝热剂中的铝与NaOH反应,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑ ,铝与氢气的关系式为
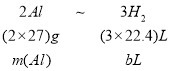
所以:m(Al)=![]() 。
。
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑,![]() 。
。
②在铝热反应后的生成物中加入足量盐酸,Al2O3、Fe均与盐酸发生反应,但只有盐酸与Fe反应时才放出气体。
Fe+2HCl=FeCl2+H2↑,要知道放出多少气体,必须知道铁的质量或Fe2O3的质量,但题目要求的是Al与NaOH溶液、Fe与盐酸产生H2体积比,只要知道铝热剂中Al与Fe的物质的量之比即可求出。
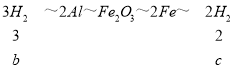
故c∶b=2∶3。
故答案为:2∶3