题目内容
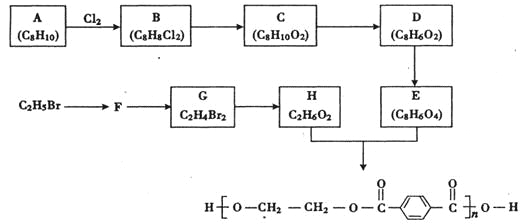
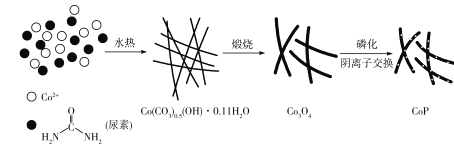
【题目】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
(1)基态P原子的电子排布式为___。P在元素周期表中位于___区。
(2)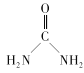 中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
(3)CO32-中C的价层电子对数为___,其空间构型为___。
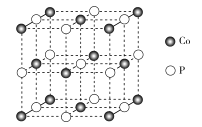
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加德罗常数的值, 则其晶胞密度为___g.cm-3(列出计算式即可)。
【答案】![]() p sp2 N>O>C O>N>C 3 平面正三角形
p sp2 N>O>C O>N>C 3 平面正三角形 ![]()
【解析】
(1)基态P原子的电子排布式为![]() ,P在元素周期表中位于p区;
,P在元素周期表中位于p区;
(2)尿素C原子上没有孤对电子,形成3个σ键,所以尿素分子中碳原子的杂化方式为sp2杂化,C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的;元素原子的得电子能力越强,则电负性越大;
(3)CO32-中C的价层电子对数=![]() 且不含孤电子对,根据价层电子对互斥理论判断空间结构;
且不含孤电子对,根据价层电子对互斥理论判断空间结构;
(4)晶胞密度计算时棱上计![]() ,角上计
,角上计![]() ,面上计
,面上计![]() ,内部计1。利用公式
,内部计1。利用公式![]() ,计算其密度。
,计算其密度。
(1)基态P原子的电子排布式为![]() ,P在元素周期表中位于p区;故答案为:
,P在元素周期表中位于p区;故答案为:![]() ;p;
;p;
(2)尿素C原子上没有孤对电子,形成3个σ键,所以尿素分子中碳原子的杂化方式为sp2杂化,C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,故第一电离能由大到小的顺序是N>O>C,元素原子的得电子能力越强,则电负性越大,电负性由大到小的顺序为O>N>C,故答案为:sp2;N>O>C;O>N>C;
(3)CO32-中C的价层电子对数=![]() 且不含孤电子对,空间构型为平面正三角形;故答案为:3;平面正三角形;
且不含孤电子对,空间构型为平面正三角形;故答案为:3;平面正三角形;
(4)由晶胞图可知,一个晶胞中含P原子数为![]() ,含钴原子数为
,含钴原子数为![]() ,所以一个晶胞质量为
,所以一个晶胞质量为![]() ;由图可知,由于相邻两个钴原子的距离为n pm,则立方体的棱长为
;由图可知,由于相邻两个钴原子的距离为n pm,则立方体的棱长为![]() n pm,则体积
n pm,则体积![]() ,密度
,密度![]() ,故答案为:
,故答案为:![]() 。
。