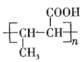
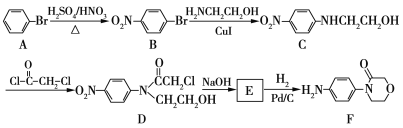
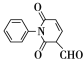
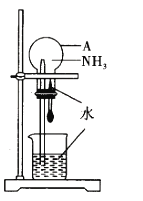
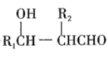题目内容
【题目】将25℃时浓度均为0.1mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图所示。下列说法错误的是( )

A.曲线II表示HA溶液的体积
B.x点存在c(A-)+c(OH-)=c(B+)+c(H+)
C.电离平衡常数:K(HA)>K(BOH)
D.x、y、z三点对应的溶液中,y点溶液中水的电离程度最大
【答案】C
【解析】
A. 开始时溶液显酸性,说明酸的体积大,所以曲线II表示HA溶液的体积,故A正确;
B. 根据电荷守,x点存在c(A-)+c(OH-)=c(B+)+c(H+),故B正确;
C. 根据y点,HA和BOH等体积、等浓度混合,溶液呈碱性,说明电离平衡常数:K(HA)<K(BOH),故C错误;
D. x点酸剩余、y点恰好反应、z点碱剩余,所以三点对应的溶液中,y点溶液中水的电离程度最大,故D正确;
选C。

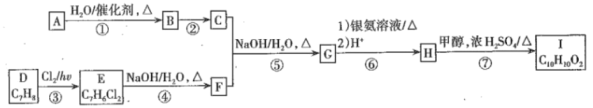
【题目】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。部分技术流程如下:
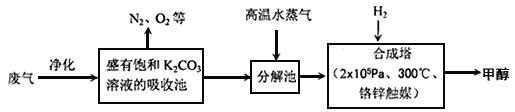
⑴合成塔中反应的化学方程式为_________;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了_____。
(2)从合成塔分离出甲醇的原理与下列_______操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式_____。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
II.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为________。
(2)下列描述能说明反应达到平衡的是_______
A.装置内气体颜色不再改变 B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变 D.容器内气体密度保持不变
(3)该温度下平衡常数K=_______,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_________ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO和2mol H2,此时CO的转化率将_____(填“增大”、“减小”或“不变”)
Ⅲ. 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
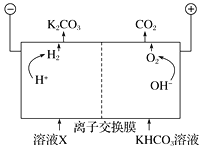
①在阳极区发生的反应包括_________和H++HCO![]() ===H2O+CO2↑。
===H2O+CO2↑。
②简述CO32-在阴极区再生的原理:______。
【题目】钠、铝是两种重要的金属,其单质及化合物在人们的日常生活、生产及科学研究中具有广泛的用途。回答下列问题:
(1)基态铝原子的电子排布图是____________________。
(2)与Al3+具有相同的电子层结构的简单阴离子有__________(填离子符号),其中形成这些阴离子的元素中,电负性最强的是__________(填元素符号,下同),第一电离能最小的是__________。
(3)Al、Cl的电负性如下表:
元素 | Al | Cl |
电负性 | 1.5 | 3.0 |
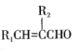
则AlCl3为________晶体(填晶体类型);AlCl3升华后蒸气的相对分子质量约为267,则该蒸气分子的结构式是____________(标明配位键)。
(4)氢化铝钠(NaAlH4)是重要的有机合成中还原剂。
①![]() 的空间构型为____________。
的空间构型为____________。
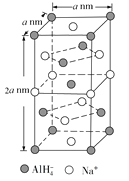
②NaAlH4的晶胞如下图所示,与Na+紧邻且等距的![]() 有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。
有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。