题目内容
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ? 。
(2)实验室还可在 ? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
(二)实验探究
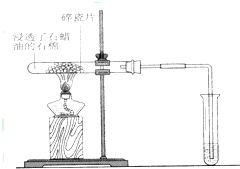
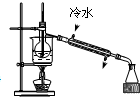
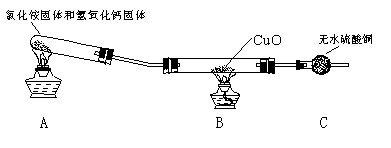
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 ? 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式 ?
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: ?
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。据此可推得A为 ? ,由此得到的结论是 ? 。

(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ? 。
(2)实验室还可在 ? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
(二)实验探究
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 ? 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式 ?
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: ?
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。据此可推得A为 ? ,由此得到的结论是 ? 。
(一)(1)2NH4Cl+Ca(OH)2 △ CaCl2+2NH3↑+2H2O (2分)
(2)氢氧化钠固体(或生石灰或碱石灰) (1分)
(二)(1)在装置A和B之间增加装有碱石灰的干燥管 (2分)
(2)3CuO+2NH3 △ 3Cu+N2+3H2O (2分)
(三)(1)取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有 (2分)
(2)Cu2O (2分) CuO比Cu2O的热稳定性差 (1分)
(2)氢氧化钠固体(或生石灰或碱石灰) (1分)
(二)(1)在装置A和B之间增加装有碱石灰的干燥管 (2分)
(2)3CuO+2NH3 △ 3Cu+N2+3H2O (2分)
(三)(1)取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有 (2分)
(2)Cu2O (2分) CuO比Cu2O的热稳定性差 (1分)
本题综合考查了氨气的性质、对实验方案的评价和改进、实验方案的设计。
(一)实验室制氨气利用NH4++OH- NH3·H2O
NH3·H2O NH3↑+ H2O的平衡移动实现。故把浓氨水滴入碱石灰或是氢氧化钠固体中,吸水有利平衡正向移动,且放出的热也有利平衡正向移动。
NH3↑+ H2O的平衡移动实现。故把浓氨水滴入碱石灰或是氢氧化钠固体中,吸水有利平衡正向移动,且放出的热也有利平衡正向移动。
(二)无水硫酸铜在B后用来检验产物是否含水,但制的氨气未干燥故会产生干扰,所以要先干燥氨气再检验是否有水生成。
(三)实验设计的出发点还是物质性质上的差异。由题意可知,Cu2O可以和非氧化性的酸溶液反应,最终生成Cu2+和Cu。而红色的单质Cu则不能和非氧化性的酸溶液反应。所以利用非氧化性的酸(稀硫酸、盐酸),看是否有Cu2+生成来检验。
由产物颜色可以判断为Cu2O,说明高温下稳定好的才能最终存在。
(一)实验室制氨气利用NH4++OH-
 NH3·H2O
NH3·H2O NH3↑+ H2O的平衡移动实现。故把浓氨水滴入碱石灰或是氢氧化钠固体中,吸水有利平衡正向移动,且放出的热也有利平衡正向移动。
NH3↑+ H2O的平衡移动实现。故把浓氨水滴入碱石灰或是氢氧化钠固体中,吸水有利平衡正向移动,且放出的热也有利平衡正向移动。(二)无水硫酸铜在B后用来检验产物是否含水,但制的氨气未干燥故会产生干扰,所以要先干燥氨气再检验是否有水生成。
(三)实验设计的出发点还是物质性质上的差异。由题意可知,Cu2O可以和非氧化性的酸溶液反应,最终生成Cu2+和Cu。而红色的单质Cu则不能和非氧化性的酸溶液反应。所以利用非氧化性的酸(稀硫酸、盐酸),看是否有Cu2+生成来检验。
由产物颜色可以判断为Cu2O,说明高温下稳定好的才能最终存在。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目