题目内容
将固体MnC2O4·2H2O放在一个可以称出质量的容器里加热,固体质量随温度变化
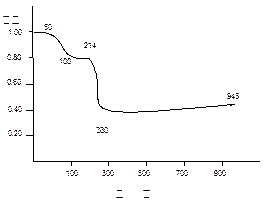
的关系如图所示(相对原子质量:H 1.0, C 12.0, O 16.0, Mn 55.0 ):
纵坐标是固体的相对质量。
说出在下列五个温度区间各发生什么变化,并简述理由:
0~50℃;50~100℃;100~214℃;214~280℃;280~943℃

的关系如图所示(相对原子质量:H 1.0, C 12.0, O 16.0, Mn 55.0 ):
纵坐标是固体的相对质量。
说出在下列五个温度区间各发生什么变化,并简述理由:
0~50℃;50~100℃;100~214℃;214~280℃;280~943℃
0~50℃ MnC2O4·2H2O稳定区域 (1分)
50~100℃ MnC2O4·2H2O = MnC2O4 + 2H2O (2分)
179 143 143/179=" 0.80 " (1分)
100~214℃ MnC2O4 稳定区域 (1分)
214~280℃ MnC2O4 =" MnO" + CO + CO2 (2分)
143 71 71/179 =" 0.40 " (1分)
280~943℃ 3MnO +1/2O2 = Mn3O4 76.3/179 =" 0.43 " (2分)
50~100℃ MnC2O4·2H2O = MnC2O4 + 2H2O (2分)
179 143 143/179=" 0.80 " (1分)
100~214℃ MnC2O4 稳定区域 (1分)
214~280℃ MnC2O4 =" MnO" + CO + CO2 (2分)
143 71 71/179 =" 0.40 " (1分)
280~943℃ 3MnO +1/2O2 = Mn3O4 76.3/179 =" 0.43 " (2分)
如果说上题最后一部分是“看表释义”,则本题是“看图识字”。试题的题面并没有说实验装置叫什么,是避免过多分散精力。这种仪器叫做热分析仪,本题涉及的是其中的热重分析。本题的解必须通过计算,计算的基础是图中的相对失重,要假设发生一个化学方程,然后进行失重的计算来论证,是否与题面的图中的实验数据相吻合。这种工作方法是实实在在的热重分析方法。当然,这种分析在很大程度上仍然有猜测的成分,因此最后的证实还要靠更多的分析手段,特别是热分解产物的结构分析(本题没有涉及)。

练习册系列答案
相关题目
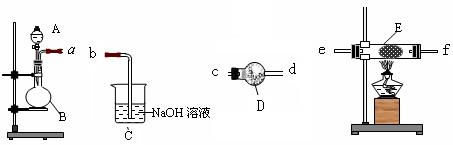
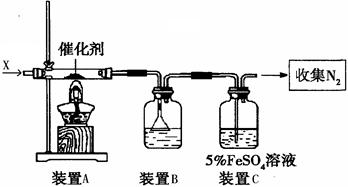
 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据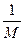 g
g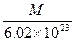 g
g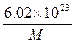 g
g