题目内容
17.下列叙述正确的是( )| A. | 1个甘氨酸分子中存在9对共用电子对(甘氨酸的结构简式为NH2-CH2-COOH) | |
| B. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2S和CS2分子都是含极性键的极性分子 | |
| D. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
分析 A.根据1个单键就是一对公用电子对,一个双键就是就是两对公用电子对;
B.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6;
C.H2S是含极性键的极性分子;CS2分子都是含极性键的非极性分子;
D.原子晶体的熔沸点的高低取决于比较共价键的强弱:原子半径越小,共价键越短,键能越大,熔沸点越高.
解答 解:A.1个甘氨酸 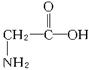 含有8个单键,1个双键,所以分子中存在10对共用电子,故A错误;
含有8个单键,1个双键,所以分子中存在10对共用电子,故A错误;
B.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6,Cl原子的最外层电子数为8,故B错误;
C.H2S是含极性键的极性分子,CS2分子都是含极性键的非极性分子,故C错误;
D.因为碳原子半径小于硅原子半径,所以C-C的键长<C-Si<Si-Si所以金刚石、碳化硅、晶体硅的熔点由高到低的顺序为金刚石>碳化硅>晶体硅,故D正确;
故选D.
点评 本题主要考查考查了分子内的共价键、分子的极性、原子晶体熔点的比较,难度不大.

练习册系列答案
相关题目
13.短周期元素X,Y,Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.回答下列问题:
(1)Y元素在元素周期表中的位置是第三周期第VIA族.
(2)下列能证明Y元素与Z元素的得电子能力强弱的是:BC(填序号).
A.氢化物水溶液的酸性
B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性
D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示):S2->Cl-.
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种气体,该气体与空气中的一种气体成分相同.该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.若反应中3.01×1022个电子发生转移,则有4g的CuO参加反应.
| X | ||
| Y | Z |
(2)下列能证明Y元素与Z元素的得电子能力强弱的是:BC(填序号).
A.氢化物水溶液的酸性
B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性
D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示):S2->Cl-.
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种气体,该气体与空气中的一种气体成分相同.该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.若反应中3.01×1022个电子发生转移,则有4g的CuO参加反应.
8.已知A、B、C是短周期的三种元素,原子序数依次递增,A、C同主族;A、B形成的化合物中,A的质量分数为40%;A、C形成的化合物中A的质量分数为50%或60%,以下说法不正确的是( )
| A. | 最高正价B<A=C | |
| B. | A、B形成的化合物中只含有离子键,A、C形成的化合物中只含有共价键 | |
| C. | A、B、C三种元素能组成两种不同的化合物 | |
| D. | A、C形成的一种化合物既有氧化性又有还原性 |
5.下列说法正确的是( )
| A. | 能使澄清石灰水变浑浊的气体一定是CO2 | |
| B. | 能使品红溶液褪色,将其煮沸又变红的无色气体为SO2 | |
| C. | 与浓H2SO4反应可产生SO2的一定是亚硫酸的正盐 | |
| D. | 某酸性溶液经分析含大量S2-,SO42-,MnO4- |
12.下列化合物中,既含有离子键、又含有共价键的是( )
| A. | HCl | B. | Na2O2 | C. | H2O | D. | CaCl2 |
2.密闭的烧瓶里盛放气体NO2,在25时建立如下平衡:2NO2?N2O4,该反应正反应为放热反应,把烧瓶置于100的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是( )
| A. | 平均相对分子质量 | B. | 混合气体的密度 | ||
| C. | 烧瓶内气体压强 | D. | 气体的物质的量 |
9.下列说法正确的是( )
| A. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 | |
| B. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| C. | 分子式为C5H12的烃,其一氯代物有3种 | |
| D. | 苯乙烯分子中所有原子可能在同一平面上 |
6. 以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )
以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )
 以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )
以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )| A. | 该电池能够在高温下工作 | |
| B. | 放电过程中,H+从左侧区向右侧区迁 | |
| C. | 负极反应为:C4H8O2+6H2O-20e-═4CO2↑+20H+ | |
| D. | 电池工作时右侧区域的pH将升高 |
7.下列化学用语正确的是( )
| A. | Cl-的结构示意图: | |
| B. | 质子数为53,中子数为78的碘原子:I | |
| C. | 光导纤维主要成分的化学式:Si | |
| D. | H216O、D216O、H218O、D218O互为同位素 |