题目内容
2.密闭的烧瓶里盛放气体NO2,在25时建立如下平衡:2NO2?N2O4,该反应正反应为放热反应,把烧瓶置于100的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是( )| A. | 平均相对分子质量 | B. | 混合气体的密度 | ||
| C. | 烧瓶内气体压强 | D. | 气体的物质的量 |
分析 升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进行,混合物的物质的量增大,平均分子量减小,但是气体的总质量是守恒的,所以质量不变,所以总的物质的量增大了,所以压强会发生改变,气体的总质量是守恒的,烧瓶的体积也是不变的,所以密度不变,由此分析解答.
解答 解:把烧瓶置于100℃沸水中,升高了温度,该反应向着逆向移动,
A、反应两边都是气体,气体的总质量不变;反应方程式两边气体的体积不相等,平衡向着逆向移动,混合物的物质的量增大,平均分子量减小,所以反应前后气体的平均分子量不相同,故A错误;
B、反应两边都是气体,气体的总质量不变,烧瓶的容积固定,根据$ρ=\frac{m}{V}$,气体的密度一定不会变化,故B正确;
C、由于升高温度,平衡向着逆向移动,气体的物质的量增大,所以压强也增大,故C错误;
D、方程式两边气体的体积不相等,平衡向着逆向移动,混合气体的物质的量增大,所以反应前后气体的物质的量不相等,故D错误;
故选B.
点评 本题考查了温度对化学平衡的影响,题目难度中等,可以根据平衡移动原理判断温度对化学平衡的影响,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
18.下列各组离子能大量共存的是( )
| A. | Fe3+、Mg2+、I-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | H+、Na+、Ca2+、ClO- | D. | Ba2+、K+、OH-、CO32- |
13.下列应用或事实中,与胶体的制备或性质没有关系的是( )
| A. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
10.下列有关化学用语表示正确的是( )
| A. | 氯化钙的电子式: | |
| B. | 168O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
17.下列叙述正确的是( )
| A. | 1个甘氨酸分子中存在9对共用电子对(甘氨酸的结构简式为NH2-CH2-COOH) | |
| B. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2S和CS2分子都是含极性键的极性分子 | |
| D. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
7.区别SO2和CO2气体可选用的方法是( )
| A. | 通入品红溶液中 | B. | 用带火星的木条检验 | ||
| C. | 通入澄清石灰水中 | D. | 通入石蕊溶液中 |
14.根据所学的元素周期律知识,下列说法正确的是( )
| A. | 碱金属元素从上到下随核电荷数的增加,单质的熔沸点逐渐升高 | |
| B. | 第二周期元素(除稀有气体外)从左到右随核电荷数的增加,其最高正价从+1到+7 | |
| C. | Se的氢化物应该比硫化氢稳定 | |
| D. | Sr的碳酸盐应该难溶于水 |
11.有下列物质:①C2H6、②C2H4、③C2H2、④H2、⑤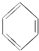 、⑥
、⑥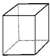 、⑦
、⑦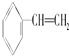 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬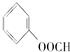 .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
 、⑥
、⑥ 、⑦
、⑦ 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬ .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )| A. | ⑤⑥⑦ | B. | ④⑨⑩ | C. | ⑪⑫⑬ | D. | ①②③⑧ |
12.氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是( )
| A. | NaCN的水溶液显碱性 | |
| B. | 1mol/L氢氰酸溶液的pH约为5 | |
| C. | 10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比盐酸溶液弱 |