题目内容
12.下列说法不正确的是( )| A. | 铝原子核外有13种不同运动状态的电子 | |
| B. | 前四周期元素中,基态原子中成对电子数与其所在周期数相同的元素有6种 | |
| C. | 第一电离能介于B、N之间的第二周期元素有3种 | |
| D. | HF的水溶液中存在4种氢键 |
分析 A、原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态;
B、当原子位于第一周期时,其成对电子数是1,只能是1s2;
当原子位于第二周期时,其成对电子数是2,只能是1s22s2,1s22s22p1,1s22s22p2,1s22s22p3;
当原子位于第三周期时,其成对电子数是3,不存在;
当原子位于第四周期时,其成对电子数是4,不存在;
C、同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
D、氟化氢水溶液里,氟化氢分子之间、水分子之间、氟化氢分子中的氢原子和水分子中的氧原子之间、水分子中的氢原子和氟化氢分子中的氟原子之间都能形成氢键.
解答 解:A.原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,铝原子核外有13个电子,所以有13种不同运动状态的电子,故A正确;
B.当原子位于第一周期时,其成对电子数是1,只能是1s2,符合条件的为He元素;
当原子位于第二周期时,其成对电子数是2,只能是1s22s2,1s22s22p1,1s22s22p2,1s22s22p3,符合条件的为Be、B、C、N三种元素;
当原子位于第三周期时,其未成对电子数是3,不存在;当原子位于第四周期时,其未成对电子数是4,不存在;通过以上分析知,符合条件的有5种元素,故B错误;
C、同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;故C正确;
D、氟化氢水溶液里,氟化氢分子之间、水分子之间、氟化氢分子中的氢原子和水分子中的氧原子之间、水分子中的氢原子和氟化氢分子中的氟原子之间都能形成氢键,所以该溶液中能形成4种氢键,故D正确;
故选:B.
点评 本题考查了原子核外电子排布以及氢键的形成条件,明确各个能级上排列电子数及构造原理即可解答,注意第四周期元素核外电子排布规则,出现能级交错,为易错点.

| A. | N2 | B. | F2 | C. | O2 | D. | C12 |
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4═Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C═Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3═Na2CO3+CaS
下列说法正确的是( )
| A. | ②③两步都是氧化还原反应 | B. | 只有第②步是氧化还原反应 | ||
| C. | 该方法对生产设备基本没有腐蚀 | D. | 该方法对环境污染较小 |
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为 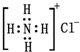 | |
| D. | 氯离子结构示意图为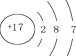 |
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
| A. | 甲烷的燃烧热为a kJ•mol-1 | B. | a一定大于0 | ||
| C. | a+b=-638.5 | D. | b一定小于0 |
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,B溶液的pH小于7,A、B的溶液中水的电离程度相同;D溶液焰色反应(透过蓝色钴玻璃)显紫色.
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象.
(1)A的化学式:CH3COONa.
(2)用离子方程式表示B的水溶液pH小于7原因NH4++H2O?NH3•H2O+H+.
(3)写出C溶液和D溶液反应的离子方程式Ba2++SO42-=BaSO4↓.
(4)pH=10的A溶液和pH=10的C溶液中水的电离程度大的是CH3COONa(填写A或C的化学式).
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
| X | ||
| M |
乙(g)+Z2(g)→甲(g)+Q2(g),每生成1mol Q2放热57.8kJ.写出该反应的热化学方程式:2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol或4HCl(g)+O2(g)=2H2O(g) 2Cl2(g)△H=-115.6 kJ/mol;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式说明)NH4++H2O?NH3.H2O+H+;该溶液中各种离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(3)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:
2CO+2NO
 N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;(4)将1mol丙气体和1mol丁气体充入装有催化剂的恒压容器中,充分反应达平衡后:①若气体体积较原来减少23%,则丁的转化率为92%;
②已知该反应△H<0,则升高温度,平衡常数K值将变小(填变大、变小或不变);
③若仅将压强增大为原来的2倍,再次达平衡后,混合气体中丁的体积分数将变小(填变大、变小或不变).
(5)由X的最简单气态氢化物、Z的单质和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为CH4+10OH--8e-=CO32-+7H2O.
| A. | pH=0的某溶液 | B. | 0.1 mol•L-1 NaOH 溶液 | ||
| C. | 0.1mol•L-1 HCl 溶液 | D. | 0.1 mol•L-1的 NaCl 溶液 |
 .
.