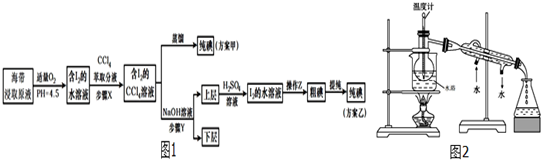
题目内容
1.为了除去KNO3固体中少量MgSO4和Ca(NO3)2杂质,须进行下列六项操作,正确的次序是①加水溶解;②加热蒸发得到晶体;③加入过量Ba(NO3)2溶液;④加入过量硝酸;⑤加入过量 K2CO3 溶液; ⑥加入过量的 KOH 溶液⑦过滤.( )| A. | ①⑤③⑥⑦④② | B. | ①⑤③④⑥⑦② | C. | ①③④⑥⑦⑤② | D. | ①③⑤⑥⑦④② |
分析 通过转化为沉淀的方法除去KNO3中混有的少量可溶于水的MgSO4和Ca(NO3)2杂质.要先加过量的Ba(NO3)2溶液除去硫酸根离子和镁离子,然后用K2CO3溶液去除过量的钡离子和钙离子;注意K2CO3溶液要在Ba(NO3)2溶液之后加入,要先除硫酸根离子和镁离子,然后再除钙离子,碳酸钾溶液可以除去过量的钡离子,如果加入的顺序反了,过量的钡离子则无法除去;硝酸要放在最后,来除去过量的Ba(NO3)2和K2CO3溶液.
解答 解:通过转化为沉淀的方法除去KNO3中混有的少量可溶于水的MgSO4和Ca(NO3)2杂质.可采取加水溶解→加入过量Ba(NO3)2溶液,与MgSO4发生反应,生成BaSO4沉淀和硝酸镁→加过量K2CO3溶液,与Ca(NO3)2和过量Ba(NO3)2溶液发生反应,生成CaCO3沉淀和BaCO3沉淀和氯化钾,加入过量的 KOH 溶液生成氢氧化镁沉淀,→过滤,滤出上述步骤生成的沉淀→加过量硝酸,与过量K2CO3溶液发生反应,生成KNO3、水和二氧化碳气体→加热蒸发得到晶体.
操作中应依次加入过量的Ba(NO3)2溶液、碳酸钾溶液、KOH 溶液过滤后加过量硝酸,加热蒸发得到晶体,正确的操作顺序为①③⑤⑥⑦④②,
故选D.
点评 本题考查物质的分离、提纯,注意物质除杂必需条件(反应后不能引入新的杂质)为解题的关键,把握试剂的加入顺序及离子之间的反应即可解答,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
11.某温度下,在体积可变的密闭容器中,加入1molX(g)和3molY(g)发生反应达到平衡:X(g)+m Y(g)═3Z(g),在此平衡体系中加入3molZ(g),再次达到平衡后,X、Y、Z的体积分数不变.下列叙述不正确的是( )
| A. | m=3 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为原平衡的2倍 |
12.下列选项与胶体知识无关的是( )
| A. | 在豆浆里加入盐卤做豆腐 | |
| B. | 水泥、冶金厂常用高压电除去工厂烟尘,以减少对空气污染 | |
| C. | 一束平行光线照射暗箱中的蛋白质溶液时,从侧面可以看到光亮的通路 | |
| D. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体 |
9.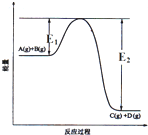 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,A的转化率增大 | |
| C. | 反应体系中加入催化剂对反应热没有影响 | |
| D. | 在反应体系中加催化剂,反应速率增大,E1、E2均减小 |
16.分类方法在化学学科的发展中起到重要的作用,下列分类标准合理的是( )
| A. | 根据碳酸钠溶于水呈碱性,碳酸钠既属于盐,又属于碱 | |
| B. | 根据物质是否能导电,将物质分为电解质、非电解质 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| D. | 根据化学反应过程中元素化合价是否发生变化,将化学反应分为氧化还原反应和非氧化还原反 应 |
13.对于反应:2SO2+O2?2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
| 编 号 | 改变的条件 | 生成SO3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大O2的浓度 | |
| ④ | 使用V2O5作催化剂 | |
| ⑤ | 压缩体积 | . |
10.下列关于物质的类别的说法正确的是( )
| A. | 能在水溶液或熔融状态下导电的物质就是电解质 | |
| B. | 胶体区别于溶液的本质是因为能产生丁达尔效应 | |
| C. | 纯碱不属于碱,干冰属于酸性氧化物 | |
| D. | Na2O和Na2O2都能与水反应生成对应的碱,它们都是碱性氧化物 |