题目内容
13.对于反应:2SO2+O2?2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)| 编 号 | 改变的条件 | 生成SO3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大O2的浓度 | |
| ④ | 使用V2O5作催化剂 | |
| ⑤ | 压缩体积 | . |
分析 影响反应速率的因素有:温度、浓度、催化剂、压强、固体的表面积等,温度越高,浓度越大,压强越大、使用催化剂均可以使反应速率越快,反之,会使反应速率减慢,以此解答该题.
解答 解:影响反应速率的因素:温度、浓度、催化剂、压强、固体的表面积等,结论是:温度越高,浓度越大,压强越大、使用催化剂均可以使反应速率加快,反之,会使反应速率减慢.
①升高温度,反应速率增大,②降低温度,化学反应速率减慢;③增大反应物O2的浓度,可以使反应速率加快;④使用V2O5作催化剂,能使反应速率加快;⑤压缩体积,会使浓度增大,或是使得压强增大,反应速率加快.
故答案为:
| 编 号 | 改变的条件 | 生成SO3的速率 |
| ① | 升高温度 | 增大 |
| ② | 降低温度 | 减小 |
| ③ | 增大O2的浓度 | 增大 |
| ④ | 使用V2O5作催化剂 | 增大 |
| ⑤ | 压缩体积 | 增大 |
点评 本题考查外界条件对反应速率的影响,为高频考点,题目难度不大,注意外界条件对活化分子的影响,注重基础知识的积累.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
3.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素.根据以下信息填空:
(1)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式:2N2H4+N2O4═3N2+4H2O.
(2)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,2Z+2H2O+7O2═2X+2Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(3)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3.
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(2)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,2Z+2H2O+7O2═2X+2Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(3)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3.
1.为了除去KNO3固体中少量MgSO4和Ca(NO3)2杂质,须进行下列六项操作,正确的次序是①加水溶解;②加热蒸发得到晶体;③加入过量Ba(NO3)2溶液;④加入过量硝酸;⑤加入过量 K2CO3 溶液; ⑥加入过量的 KOH 溶液⑦过滤.( )
| A. | ①⑤③⑥⑦④② | B. | ①⑤③④⑥⑦② | C. | ①③④⑥⑦⑤② | D. | ①③⑤⑥⑦④② |
8.对于可逆反应2SO2+O$\frac{\underline{\;催化剂\;}}{△}$2SO3,在混合气体中充入一定量18O2,足够长的时间后,18O原子( )
| A. | 只存在于O2中 | B. | 只存在于SO3和O2中 | ||
| C. | 只存在于SO2和O2中 | D. | 存在于SO2、SO3和O2中 |
18.欲将NaCl、沙子(主要成份SiO2)、I2晶体的混合物分离,最科学的操作顺序是( )
| A. | 溶解、结晶、过滤、升华 | B. | 加热(升华)、溶解、过滤、蒸发(结晶) | ||
| C. | 加热(升华)、溶解、蒸馏、结晶 | D. | 溶解、过滤、加热(升华)、蒸发(结晶) |
5.下列各组离子一定能大量共存的是( )
| A. | 在pH=1的溶液中:Na+、NO3-、I-、K+ | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl- | |
| C. | 常温下水电离的c(OH-)=1×10-13mol•L-1的溶液中:NH4+、HCO3-、SO42-、Cl- | |
| D. | 含有HCO3-的溶液中:K+、NH4+、NO3-、Ca2+ |
2.下列根据实验现象所得出的结论中,一定正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 无色试液中加入AgNO3溶液产生白色沉淀 | 试液中含有Cl- |
| B | 无色溶液加酚酞变红色 | 溶液的溶质是碱 |
| C | 碱性无色溶液中加入Na2CO3溶液产生白色沉淀 | 溶液中有Ca(OH)2 |
| D | 某气体能使湿润的红色石蕊试纸变蓝色 | 该气体中有NH3 |
| A. | A | B. | B | C. | C | D. | D |
3.下列各组物质,互为同系物的是( )
| A. | CH3-CH=CH2与 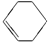 | B. | 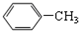 与 与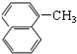 | ||
| C. | 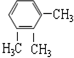 与 与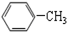 | D. | CH3CH2Cl 与CH3CHCl-CH2Cl |
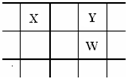 核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q.其中:在同周期中,Z的金属性最强,Q的非金属性最强; W的单质是淡黄色固体; X、Y、W在周期表中的相对位置关系如图所示:
核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q.其中:在同周期中,Z的金属性最强,Q的非金属性最强; W的单质是淡黄色固体; X、Y、W在周期表中的相对位置关系如图所示: