题目内容
【题目】以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )
![]()
则下列叙述错误的是
A.A气体是NH3,B气体是CO2
B.把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
【答案】D
【解析】
A.氨气易溶于水,二氧化碳能溶于水,依据侯德榜制碱的原理:向氨化的饱和食盐水中通入二氧化碳气体析出碳酸氢钠,加热反应制备纯碱,所以气体A为氨气,B为二氧化碳,故A正确;
B.第Ⅲ步操作是过滤操作,通过过滤得到碳酸氢钠晶体,把纯碱及碳酸氢钠与某些固体酸性物质(如酒石酸)混合可制得泡腾片,故B正确;
C.第Ⅲ步操作是过滤操作,通过过滤得到碳酸氢钠晶体,所以需要的仪器有:烧杯、漏斗、玻璃棒,故C正确;
D.第Ⅳ步操作是将晶体碳酸氢钠直接加热分解得到碳酸钠固体,故D错误;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品。
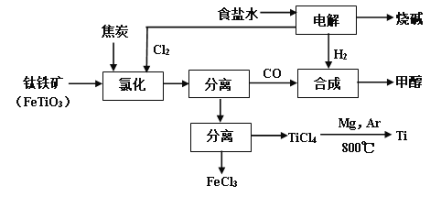
已知:合成甲醇的主反应为:CO+2H2![]() CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2![]() C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2![]() C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是__________(填写化学式)。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________。
(3)诸如上述联合生产,其优点有_______。生产中除了获得上述目标产品外,还能得到副产品________(填写化学式)。
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2 _____吨(不考虑生产过程中物质的损失及副反应)。
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
物质 | 沸点(0C) |
TiCl4 | 136 |
FeCl3 | 315 |
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:_______。