题目内容
8.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂粉精是常用的消毒剂.(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂粉精,化学反应方程式为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(2)在上述反应的反应物与生成物中:共价化合物的结构式H-O-H;只含离子键的化合物的电子式
 .
.(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
分析 (1)氯气在碱性溶液中自身发生氧化还原反应,生成氯化物和次氯酸盐,以此书写化学方程式;
(2)一般来说,非金属元素之间易形成共价键,活泼金属和活泼非金属元素之间易形成离子键,注意金属元素和非金属元素之间可能形成共价键,反应物和生成物中水未共价化合物,氯化钙只含离子键;
(3)次氯酸的酸性弱于碳酸,根据强酸制弱酸原理,漂白粉溶于水后,受空气中的CO2作用,生成CaCO3和HClO.
解答 解:(1)氯气在碱性溶液中自身发生氧化还原反应,与石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(2)上述反应的反应物与生成物中,H2O为只含有共价键的化合物,结构式为H-O-H,氯化钙中氯离子和钙离子之间只存在离子键,其电子式中,两个氯离子不能合并,氯化钙的电子式为 ,
,
故答案为:H-O-H; ;
;
(3)HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的某种物质为次氯酸,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
点评 本题考查了氯气及其化合物的性质应用,主要考查化学方程式的书写和反应原理的理解以及化学键,注意相关知识的积累,题目难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
4.用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:
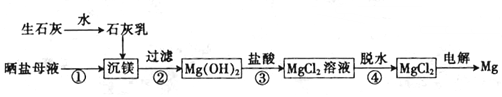
下列说法错误的是( )

下列说法错误的是( )
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
19.锂电池是一代新型高能电池,它以质量轻、能量高而受到普遍重视,目前已成功研制多种锂电池.某种锂电池的总反应为Li+MnO2═LiMnO2,下列说法正确的是( )
| A. | Li是正极,电极反应为Li-e-═Li+ | |
| B. | Li是负极,电极反应为Li-2e-═Li2+ | |
| C. | MnO2是负极,电极反应为MnO2+e-═MnO2- | |
| D. | Li是负极,电极反应为Li-e-═Li+ |
16.由氧气与氢气反应生成1mol液态水放出285.75KJ热量,下列热化学方程式书写正确的是( )
| A. | 2H2+O2→2H2O+285.75KJ | B. | 2H2(g)+O2 (g)→2H2O(l)+571.5KJ | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)→H2O(g)+285.75KJ | D. | H2(g)+$\frac{1}{2}$O2(g)→H2O(l)-285.75KJ |
13.现有25mL物质的量浓度相同的三种溶液:①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,下列说法正确的是( )
| A. | 三种溶液pH的大小顺序是③>②>① | |
| B. | 若将三种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若三种溶液的pH均为11,则物质的量浓度的大小顺序是③>①>② | |
| D. | 若分别加入25mL等物质的量浓度的盐酸后,pH最大的是① |
20.二氯化二硫(S2Cl2)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H2O相似,熔点为193K,沸点为411K,遇水很容易反应,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得.下列有关说法正确的是( )
| A. | S2Cl2晶体中存在离子键和极性共价键 | |
| B. | S2Cl2分子中各原子均达到8电子稳定结构 | |
| C. | S2Cl2的水溶液能导电,所以S2Cl2是电解质 | |
| D. | S2Cl2与水反应后生成的气体通入石蕊试液中,现象是溶液先变红后褪色 |
5.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Ca2+、Ba2+、Cl-、CO32-、SO42-.现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到气体0.04mol;
第三份加入足量BaCl2 溶液后,得沉淀6.27g,经足量盐酸洗涤后剩余沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到气体0.04mol;
第三份加入足量BaCl2 溶液后,得沉淀6.27g,经足量盐酸洗涤后剩余沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | K+一定存在,且c(K+)≥0.02mol•L-1 | B. | 100mL溶液中含CO32-0.0lmol | ||
| C. | K+不一定存在 | D. | Cl-一定存在 |
 ;溴化钠中存在的化学键是离子键,
;溴化钠中存在的化学键是离子键, ,溴化钠的电离方程式为NaBr=Na++Br-.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.
,溴化钠的电离方程式为NaBr=Na++Br-.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.
