题目内容
16.由氧气与氢气反应生成1mol液态水放出285.75KJ热量,下列热化学方程式书写正确的是( )| A. | 2H2+O2→2H2O+285.75KJ | B. | 2H2(g)+O2 (g)→2H2O(l)+571.5KJ | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)→H2O(g)+285.75KJ | D. | H2(g)+$\frac{1}{2}$O2(g)→H2O(l)-285.75KJ |
分析 由氧气与氢气反应生成1mol液态水放出285.75KJ热量,结合物质的量与热量成正比、物质的状态判断热化学方程式,以此来解答.
解答 解:A.没有注明物质的状态,且生成2mol液态水放出571.5KJ热量,故A错误;
B.物质的状态、物质的量与热量关系均合理,故B正确;
C.H2O(g)应为H2O(l),故C错误;
D.为放热反应,而该选项为吸热,故D错误;
故选B.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的状态、热量与物质的量的关系为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
12.布洛芬是世界卫生组织推荐的儿童退烧药,是公认的儿童首选抗炎药,结构如图.下列说法正确的是( )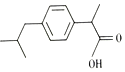

| A. | 布洛芬属于苯的同系物 | B. | 能与NaOH溶液反应 | ||
| C. | 所有原子在同一平面上 | D. | 能使溴的四氯化碳溶液褪色 |
7.下列有机物分子中,所有原子一定在同一平面的是( )
| A. | CH3CH3 | B. | CH2=CH2 | C. |  | D. | CH3COOH |
4.X、Y、Z、W是四种短周期主族元素,原子序数依次增大,X是原子半径最小的元素,元素Y的原子最外层电子数是其电子层数的2倍,元素Z的-1价阴离子和元素W的+3价阳离子的核外电子排布均与氖原子相同,下列说法中错误的是( )
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液常用于自来水的杀菌消毒 | |
| D. | 离子半径:r(Z-)>r(W3+) |
 .
.