题目内容
19.锂电池是一代新型高能电池,它以质量轻、能量高而受到普遍重视,目前已成功研制多种锂电池.某种锂电池的总反应为Li+MnO2═LiMnO2,下列说法正确的是( )| A. | Li是正极,电极反应为Li-e-═Li+ | |
| B. | Li是负极,电极反应为Li-2e-═Li2+ | |
| C. | MnO2是负极,电极反应为MnO2+e-═MnO2- | |
| D. | Li是负极,电极反应为Li-e-═Li+ |
分析 由锂电池的总反应为Li+MnO2═LiMnO2,可知Li失去电子,Li作负极,正极上Mn得到电子,以此来解答.
解答 解:由锂电池的总反应为Li+MnO2═LiMnO2,可知Li失去电子,Li作负极,负极反应为Li-e-═Li+;正极上Mn得到电子,正极反应为MnO2+e-═MnO2-,
故选D.
点评 本题考查原电池,为高频考点,把握电极判断、电极反应的书写为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应与电池反应的联系,题目难度不大.

练习册系列答案
相关题目
15.下列叙述中不正确的是( )
| A. | 在离子化合物中也可能含有共价键 | |
| B. | 非金属元素的原子之间形成的化学键一定是共价键 | |
| C. | 含共价键的化合物不一定是共价化合物 | |
| D. | 含离子键的化合物一定是离子化合物 |
10.amL三种气态烃的混合物与足量氧气混合点燃爆炸后,恢复到原来的状态(常温常压),体积共缩小2amL.则三种烃可能是( )
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | ||
| C. | CH4 C2H6 C3H8 | D. | C2H4 C2H2 CH4 |
7.下列有机物分子中,所有原子一定在同一平面的是( )
| A. | CH3CH3 | B. | CH2=CH2 | C. |  | D. | CH3COOH |
14.下列实验方案,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 氯气的氧化性 | 将湿润的淀粉KI试纸放于充满Cl2的集气瓶口,试纸变蓝 |
| B | 配制480mL 0.2mol/L NaOH溶液 | 准确称量NaOH固体4.0g溶于水,配制成500mL溶液 |
| C | 比较H2CO3和H2SO4的酸性强弱 | 室温下,用pH试纸测定浓度为 0.1mol/L Na2CO3溶液和 0.1mol/L Na2SO4溶液的pH |
| D | 鉴别Na2CO3溶液与NaHCO3溶液 | 分别加入Ca(OH)2溶液看是否产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
4.X、Y、Z、W是四种短周期主族元素,原子序数依次增大,X是原子半径最小的元素,元素Y的原子最外层电子数是其电子层数的2倍,元素Z的-1价阴离子和元素W的+3价阳离子的核外电子排布均与氖原子相同,下列说法中错误的是( )
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液常用于自来水的杀菌消毒 | |
| D. | 离子半径:r(Z-)>r(W3+) |
17.已知: ,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
 ,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )| A. | 保护 1mol 醛基时也可用2molCH3CH2OH | |
| B. | 合成 1mol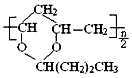 需要 1mol 需要 1mol 和 nmolCH3CH2CH2CHO 和 nmolCH3CH2CH2CHO | |
| C. | 通过上述反应合成的 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3 | |
| D. | 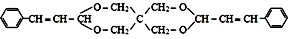 可由 C(CH2OH)4 与 可由 C(CH2OH)4 与 通过上述反应得到 通过上述反应得到 |
 .
.