��Ŀ����
����Ŀ����ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO��g��+2H2��g��CH3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯��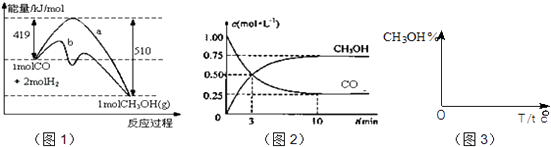
��ش��������⣺
��1���ڡ�ͼ1���У��������a��b����ʾʹ���˴������÷�Ӧ������Ӧ��
��2������˵����ȷ���� ��
A.��ʼ�����COΪ2mol
B.����COŨ�ȣ�CO��ת��������
C.������ѹǿ�㶨ʱ����Ӧ�Ѵ�ƽ��״̬
D.�����¶Ⱥ��ܱ������ݻ����䣬�ٳ���1molCO��2molH2 �� �ٴδﵽƽ��ʱ��n��CH3OH��/n��CO�����С
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��H2��=�����¶���CO��g��+2H2��g��CH3OH��g���Ļ�ѧƽ�ⳣ��ֵΪ �� �����������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ�������������С�����䡱����
��4�����ڡ�ͼ3���л���ƽ��ʱ�״��ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P1��P2 �� ��P1��P2����
��5����һ��״����ӽ���Ĥȼ�ϵ�أ��轫�״�����ת��Ϊ���������ַ�Ӧԭ����
A��CH3OH��g��+H2O��g��=CO2��g��+3H2��g������H=+49.0kJ/mol
B��CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��g������H=��192.9kJ/mol
O2��g��=CO2��g��+2H2O��g������H=��192.9kJ/mol
��֪H2O��l��=H2O��g����H=+44kJ/mol����д��32g��CH3OH��g����ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ ��
���𰸡�
��1��b,����
��2��A,C
��3��0.15mol?L��1?min��1,12 L2?mol��2,��С
��4��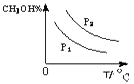
��5��CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��H=��280.9kJ/mol
O2��g��=CO2��g��+2H2O��H=��280.9kJ/mol
���������⣺��1����ͼ��֪������b�����˷�Ӧ����Ļ�ܣ���bʹ���˴������ָ÷�Ӧ�з�Ӧ������������������������������÷�ӦΪ���ȷ�Ӧ��
���Դ��ǣ�b�����ȣ�
��2��A����ͼ2��֪����0.75mol/LCH3OH����Ӧ��0.75mol/LCO��ƽ��ʱ��0.25mol/LCO����CO����ʼ���ʵ���Ϊ��0.75mol/l+0.25mol/L����2L=2mol����A��ȷ��
B������COŨ�ȣ���ٽ�������ת����������ת��������CO��ת���ʼ�С����B����
C���÷�ӦΪ��Ӧǰ��ѹǿ���ȵķ�Ӧ����ѹǿ����ʱ���÷�Ӧ�ﵽƽ��״̬����C��ȷ��
D���ٳ���1molCO��2molH2��������䣬��ѹǿ����ƽ�������ƶ����ٴδﵽƽ��ʱn��CH3OH��/n��CO��������D����
���Դ��ǣ�AC��
��3����ͼ2��֪����Ӧ�м�С��CO��Ũ��Ϊ1mol/L��0.25mol/L=0.75mol/L��10minʱ�ﵽƽ�⣬
����CO��ʾ�Ļ�ѧ��Ӧ����Ϊ ![]() =0.075molL��1min��1��
=0.075molL��1min��1��
��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=0.075molL��1min��1��2=0.15molL��1min��1��
CO��g��+ | 2H2��g�� | CH3OH��g�� | |
��ʼ��mol/L�� | 1 | 2 | 0 |
ת����mol/L�� | 0.75 | 1.5 | 0.75 |
ƽ�⣨mol/L�� | 0.25 | 0.5 | 0.75 |
��ѧƽ�ⳣ��K= ![]() =
= ![]() =12 L2mol��2��
=12 L2mol��2��
����Ӧ�Ƿ��ȷ�Ӧ�¶�Խ��KֵԽС��
���Դ��ǣ�0.15molL��1min��1��12 L2mol��2����С��
��4��CO��g��+2H2��g��CH3OH��g����H��0�����¶�Խ�ߣ�����Ӧ���еij̶�Խ�״��ĺ�����Խ�ͣ�ѹǿ����Ӧ������еij̶ȴ���״��ĺ����ߣ��״��ٷֺ������¶�T�仯��ͼΪ  �����Դ��ǣ�
�����Դ��ǣ�  ��
��
��5��32g��CH3OH��g����Ϊ1mol��
��CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��g����H=��192.9kJ/mol ��
O2��g��=CO2��g��+2H2O��g����H=��192.9kJ/mol ��
H2O��l��=H2O��g����H=+44kJ/mol ��
���ݸ�˹���ɢ٩��ڡ�2�� CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��280.9kJ/mol
O2��g��=CO2��g��+2H2O��l����H=��280.9kJ/mol
���Դ��ǣ�CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��280.9kJ/mol��
O2��g��=CO2��g��+2H2O��l����H=��280.9kJ/mol��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��һ��ԭ����ܷ�ӦΪZn+Cu2+=Zn2++Cu���õ�ص缫���ϼ��������Һ������ ( )
ѡ�� | ���� | ���� | �������Һ |
A | Zn | Cu | CuCl2 |
B | Zn | Cu | H2SO4 |
C | Cu | Zn | CuSO4 |
D | Zn | Ag | CuSO4 |
A.AB.BC.CD.D