题目内容
【题目】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:(已知TeO2微溶于水,易溶于强酸和强碱)
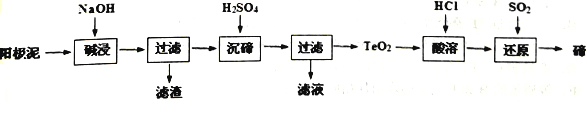
下列有关说法不正确的是
A. 将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率
B. “沉碲”时为使碲元素沉淀充分,应加入过量的硫酸
C. “碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O
D. 若提取过程碲元素的回收率为90%,则处理IKg这种阳极泥最少需通入标准状况下SO220.16L
【答案】B
【解析】本流程目的为利用阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲,所以先要进行除杂,最后提取Te。根据TeO2微溶于水,易溶于较浓的强酸和强喊,流程中先加碱溶,过滤除去杂质,得到溶液,再加硫酸沉降经过滤得到TeO2沉淀,再用盐酸溶解生成四氯化碲,再用二氧化硫还原制成碲单质。
A、研磨增大接触面积,加热均能提高“碱浸”的速率和效率,故A正确;B、由已知信息可知,TeO2微溶于水,易溶于强酸和强碱,是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,生成TeO32-,再加入H2SO4;生成H2TeO3沉淀,由TeO2是两性可推断,H2TeO3也应是两性,再沉降的过程中,硫酸若过量,可能导致H2TeO3的溶解,造成产品的损失,故B正确;C、根据B选项的分析,可知C正确;D、1kg阳极泥中含TeO2的质量为1000g×8%=80g,碲元素的回收率为90%,则有80g×90%=72g的TeO2被还原。每摩尔TeO2得4mol电子,每摩尔SO2失去2mol电子,则有关系式:1TeO2~2SO2,V(SO2)= ![]() =20.16L,故D正确。选C。
=20.16L,故D正确。选C。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
