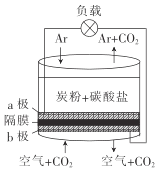
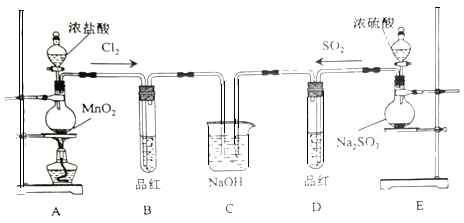
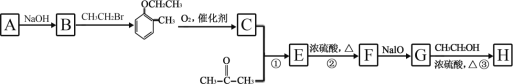
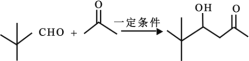
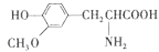
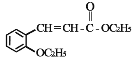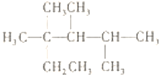��Ŀ����
����Ŀ����һ��������ܱ������У��������·�Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ������ش��������⣺
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ������ش��������⣺
T/�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��___��
��2���÷�ӦΪ___��Ӧ��ѡ�����ȡ����ȣ���
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2����c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ___�档���¶��¼���2molCO2��g����2molH2��g������ַ�Ӧ���ﵽƽ��ʱ��H2��ת����Ϊ___��
��4����800��ʱ������������Ӧ��ijһʱ�̲�������ڸ����ʵ�Ũ�ȷֱ�Ϊ��CO2��g��Ϊ2 mol/L��H2��g��Ϊ2mol/L��CO��g��Ϊ1mol/L��H2O��g��Ϊ3mol/L���������淴Ӧ���ʵĹ�ϵΪv������___v���棩�����������
���𰸡�c��CO����c��H2O��/c��CO2����c��H2�� �� 830 50�� ��
��������
��1��CO2(g)+H2(g)CO(g)+H2O(g)�Ļ�ѧƽ�ⳣ������ʽK=c(CO)![]() c(H2O)/c(CO2��
c(H2O)/c(CO2��![]() c(H2),��ˣ�������ȷ���ǣ�c(CO)
c(H2),��ˣ�������ȷ���ǣ�c(CO)![]() c(H2O)/c(CO2)
c(H2O)/c(CO2)![]() c(H2);
c(H2);
��2������ͼ����֪�����¶ȵ����ߣ�ƽ�ⳣ��������˵���÷�Ӧ�������ȷ�Ӧ���𰸣�����
ƽ��״̬��ָ���淴Ӧ������ȣ������ʵ������ٸı��״̬����Ը÷�Ӧ��������ϵ����ͬ����Ӧ�����и����ʵ������ʵ����Ƕ�ֵ����ѹǿҲ�Ƕ�ֵ��������Ϊƽ���жϵı�־����d��ֻ��һ�����������Ƿ�ƽ��û�й�ϵ
��3����c(CO2)![]() c(H2)��c(CO)
c(H2)��c(CO)![]() c(H2O)����֪K=1���ɱ������ݿɲ��Ϊ830�棻 ���¶��¼���2molCO2(g)��2molH2(g)����ַ�Ӧ���ﵽƽ��ʱ��
c(H2O)����֪K=1���ɱ������ݿɲ��Ϊ830�棻 ���¶��¼���2molCO2(g)��2molH2(g)����ַ�Ӧ���ﵽƽ��ʱ��
�ɷ�ӦCO2(g) �� H2(g)![]() CO(g)�� H2O
CO(g)�� H2O
��ʼ���� 2/v 2/v 0 0
�仯�� x x x x
ƽ���� 2/v-x 2/v-x x x
K=x2/(2/v-x)2=1�����x=1/v ,H2��ת����=1/2![]() 100
100![]() =50
=50![]() ;
;
�𰸣�830; 50![]() ��
��
��4����ͼ����֪��800��ʱ,K=0.9���ɷ�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)��֪��Q=1
CO(g)��H2O(g)��֪��Q=1![]() 3/2
3/2![]() 2=0.75<0.9������ƽ��Ӧ�����ƶ���v(��)��v(��0)���𰸣�����
2=0.75<0.9������ƽ��Ӧ�����ƶ���v(��)��v(��0)���𰸣�����