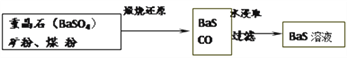
题目内容
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
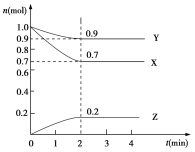
(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________________________。
(3)当反应进行到第___min,该反应达到平衡。此时,v(正)____v(逆) (填“>”、“<”或“=”)。
【答案】 0.5mol/L 10% 0.05mol/(Lmin) 3X + Y ![]() 2Z 2 =
2Z 2 =
【解析】根据图像可知X、Y的物质的量减少,是反应物,Z的物质的量增加,是生成物,根据变化量之比是化学计量数之比以及反应速率的含义、平衡状态的特征分析解答。
(1)根据图像可知起始时X的浓度为c(X)=1.0mol÷2L=0.5mol/L;反应从开始至2分钟末Y的物质的量减少了1.0mol-0.9mol=0.1mol,则Y的转化率为α(Y)=0.1mol/1.0mol×100%=10%;2min末Z的浓度是0.2mol÷2L=0.1mol/L,则用Z的浓度变化表示的平均反应速率为v(Z)=0.1mol/L÷2min=0.05mol/(Lmin)。
(2)2min时X、Y、Z的物质的量的变化量之比是0.3mol:0.1mol:0.2mol=3:1:2,因此该反应的化学方程式为3X+Y![]() 2Z。
2Z。
(3)根据图像可知当反应进行到第2min时,物质的浓度不再发生变化,因此该反应达到平衡状态,此时v(正)=v(逆)。

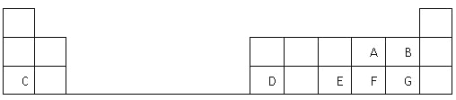
【题目】某兴趣小组甲设计了以下装置和方法测定空气中SO2含量.你认为可行的操作是
序号 | A | B | C |
装置 |
|
|
|
原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
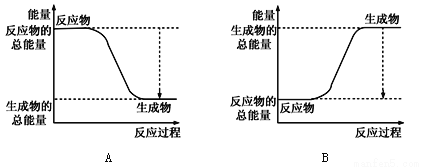
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
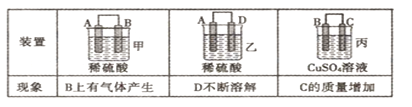
①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
【题目】下列有关实验装置及实验方案的设计不正确的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
A. A B. B C. C D. D