题目内容
9.下列叙述正确的是( )| A. | 加碘食盐,能使淀粉显蓝色 | |
| B. | 非金属氧化物一定为酸性氧化物 | |
| C. | 浓硝酸和浓硫酸与铜反应都能表现出强氧化性和酸性 | |
| D. | 实验室可用氯化铵固体与氢氧化钠固体共热制氨气 |
分析 A.淀粉与碘单质变蓝;
B.CO、NO等属于非金属氧化物,但是不属于酸性氧化物;
C.与铜反应时,分别生成硝酸铜、二氧化氮和水;硫酸铜、二氧化硫和水;
D.氢氧化钠碱性较强易腐蚀实验仪器,导致仪器破损.
解答 解:A.加碘盐中的碘是以碘酸钾形式存在,遇到淀粉不变蓝,故A错误;
B.非金属氧化物不一定为酸性氧化物,例如CO、NO等,故B错误;
C.Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,酸中(S、N)元素的化合价部分变化,还生成盐,则都表现出强氧化性和强酸性,故C正确;
D.实验室用氢氧化钙和氯化铵固体加热制备氨气,氢氧化钠碱性较强易腐蚀实验仪器,导致仪器破损,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉浓硝酸、浓硫酸的性质、氨气的实验室制备原理是解题关键,注意加碘盐中碘元素的存在形态,题目难度不大,注意对基础知识的积累.

练习册系列答案
相关题目
19.已知某元素原子的各级电离能数值如下:I1=736kJ/mol,I2=1450kJ/mol,I3=7740kJ/mol,I4=10500kJ/mol,则该元素的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
20.两种元素可形成AB2型化合物,它们的原子序数是( )
| A. | 3和9 | B. | 6和8 | C. | 10和14 | D. | 7和12 |
17.现有X、Y、Z、M四种短周期元素,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法不正确的是( )
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| C. | 气态氢化物的稳定性:Z<M | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
4.X、Y、Z均为中学化学常见物质,在一定条件下,X能与强酸或强碱溶液发生如下图的反应(部分反应物、生成物及反应条件略去).则下列说法不正确的是( )
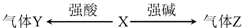
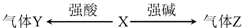
| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y在标况下的密度一定是1.96g•L-1 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
14.某无色透明的酸性溶液能与铁反应生成氢气,则该溶液中一定能够大量共存的是( )
| A. | NH4+、K+、Ba2+、Cl- | B. | Na+、K+、Cl-、SiO32- | ||
| C. | SO42-、Na+、Cu2+、Cl- | D. | SO42-、NO3-、K+、Na+ |
18.666℃和1.01×105 Pa时,反应“CaCO3(s)═CaO(s)+CO2(g)△H=+178.3kJ/mol”能自发进行的原因是( )
| A. | 温度升高 | B. | 该反应熵增 | ||
| C. | 熵增效应大于能量效应 | D. | 反应速率加快 |
 下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )
下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )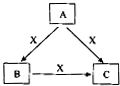 A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答: