题目内容
9.取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到固体X和滤液Y.下列叙述正确的是( )| A. | 上述四种氧化物中,至少有三种是碱性氧化物 | |
| B. | 将固体X加入氢氟酸中,X会溶解 | |
| C. | 滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种 | |
| D. | 滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
分析 MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,二氧化硅不反应,则X为SiO2,利用Y中含有氯化镁、氯化铝、氯化铁及过量的HCl.
A.上述四种氧化物中,MgO、Fe2O3属于碱性氧化物;
B.二氧化硅能与氢氟酸反应;
C.滤液Y中还含有氢离子;
D.滤液Y加热足量氨水,得到氢氧化镁、氢氧化铝、氢氧化铁沉淀.
解答 解:MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,二氧化硅不反应,则X为SiO2,利用Y中含有氯化镁、氯化铝、氯化铁及过量的HCl.
A.上述四种氧化物中,MgO、Fe2O3属于碱性氧化物,而Al2O3属于两性氧化物,SiO2属于酸性氧化物,故A错误;
B.二氧化硅能与氢氟酸反应生成四氟化硅与水,故B正确;
C.反应有剩余的盐酸,且水月发生电离,故滤液Y中的阳离子除Mg2+、Al3+、Fe3+外,还有H+离子,故C错误;
D.滤液Y中的阳离子含有Mg2+、Al3+、Fe3+,氢氧化铝是两性氢氧化物,溶于强酸、强碱,不能溶液弱碱,故滤液Y加热足量氨水,得到氢氧化镁、氢氧化铝、氢氧化铁沉淀,故D错误,
故选B.
点评 本题考查元素化合物性质、基本概念等,涉及Mg、Al、Si、Fe元素核外性质,难度不大,需要学生熟练掌握基础知识.

练习册系列答案
相关题目
20.已知瘦肉精的结构式如图,下列关于瘦肉精的说法正确的是( )
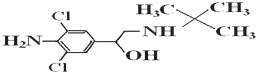

| A. | 摩尔质量为313.5g | |
| B. | 属于芳香烃类化合物 | |
| C. | 瘦肉精的分子式为C12H17Cl2N2O | |
| D. | 可发生加成反应、取代反应、消去反应 |
17.在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为手性碳原子,以*C表示.具有手性碳原子的有机物具有光学活性.下列分子中,没有光学活性的是( )
| A. | 乳酸:CH3-CH(OH)-COOH | |
| B. | 甘油:CH2(OH)-CH(OH)-CH2(OH) | |
| C. | 脱氧核糖:CH2(OH)-CH(OH)-CH(OH)-CH2-CHO | |
| D. | 核糖:CH2(OH)-CH(OH)-CH(OH)-CH(OH)-CHO |
14.1996年2月9 日欧洲一科学小组,由${\;}_{30}^{60}$Zn和${\;}_{82}^{208}$Pb两原子经核聚合,并放出一定数目的中子而制得${\;}_{112}^{227}$X原子,则两原子在核聚合过程中放出的中子数目是( )
| A. | 41 | B. | 115 | C. | 142 | D. | 162 |
1.下列说法中,正确的是( )
| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm=10-6m) |
18.下列离子方程式中,正确的是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入过量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
19.下列气体中,只能用排水法收集的是( )
| A. | NO | B. | NO2 | C. | HCl | D. | NH3 |
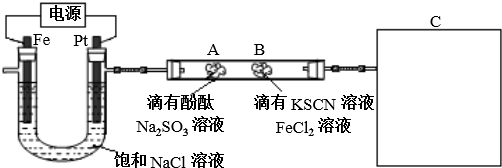
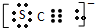 他猜想:SCN-可能被氯水氧化,导致溶液变黄.
他猜想:SCN-可能被氯水氧化,导致溶液变黄.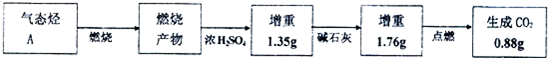
 .
.