题目内容
19.下列气体中,只能用排水法收集的是( )| A. | NO | B. | NO2 | C. | HCl | D. | NH3 |
分析 只能用排水法收集,说明该气体能够与空气中的成分发生化学反应或者气体的密度与空气的密度接近,且该气体不与水发生反应、不易溶于水,据此进行判断.
解答 解:A.一氧化氮能够与空气的氧气反应生成二氧化氮,所以只能用排水法收集,故A正确;
B.二氧化氮能够与水反应生成一氧化氮,不能够使用排水法收集,故B错误;
C.HCl极易溶于水,不能使用排水法收集,只能使用排空气法收集,故C错误;
D.氨气极易溶于水,不能用排水法收集,可以使用排空气法收集,故D错误.
故选A.
点评 本题考查气体的收集方法,题目难度不大,注意实验室收集气体选择依据气体本身的密度、溶解性等物理性质,能用排水法收集的气体应为难溶于水且不与水反应的气体.

练习册系列答案
相关题目
9.取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到固体X和滤液Y.下列叙述正确的是( )
| A. | 上述四种氧化物中,至少有三种是碱性氧化物 | |
| B. | 将固体X加入氢氟酸中,X会溶解 | |
| C. | 滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种 | |
| D. | 滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
10.C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2.将2.00g C跟16.0g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12L气体(标准状况),生成沉淀的质量为5.00g.下列说法错误的是( )
| A. | 反应后的固体混合物中还含有碳 | |
| B. | 反应后的固体混合物总质量为14.4 g | |
| C. | 反应后的固体混合物中单质Cu的质量为12.8 g | |
| D. | 反应后的固体混合物中氧化物的物质的量为0.05 mol |
7.已知S6、S8的结构如图所示.下列说法中错误的是( )
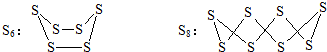
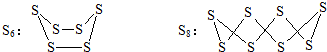
| A. | 硫单质S原子间都以σ键结合 | |
| B. | S6、S8分子中所有S原子都发生了sp3杂化 | |
| C. | S6和S8互为同位素 | |
| D. | 熔点的高低:S8>S6>S4 |
14.下列说法正确的是( )
| A. | 硫酸亚铁铵晶体要用冷水洗涤,而阿斯匹林过滤后则须用无水酒精洗涤 | |
| B. | 食醋总酸含量的测定实验中,若滴定终点没有控制好,即NaOH溶液滴加过量,则必须重做实验 | |
| C. | 火柴头中的氯元素检验的实验中,将火柴头(未燃烧)浸于水中,片刻后取少量溶液,加AgNO3溶液、稀硝酸,若出现白色沉淀,证明有氯元素 | |
| D. | 毒物误入口内,可将5~10mL稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院 |
8.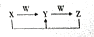 A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图.
A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图.
(1)D的元素符号为O,常用于测定文物年代的同位素是146C.
(2)A与C可形成多种10电子微粒,其中分子为NH3,离子为NH4+.
(3)C、D、E的简单离子的半径大小顺序为N3->O2->Na+;
(4)A与C可形成两种常见的化合物,化合物P(相对分子质量为17)和化合物Q(相对分子质量为32).
①写出Q的结构式: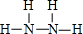
②P的水溶液可作腐蚀剂H2O2的消除剂,其反应物不污染环境,其化学方程式为2NH3.H2O+3H2O2=N2↑+8H2O.
(5)由A、B、C、D、E四种元素中的二种或二种以上元素组成的化合物X、Y、Z、W有如下转化关系: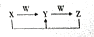 ,其中Y和Z在水溶液中存在的微粒种类相同.
,其中Y和Z在水溶液中存在的微粒种类相同.
①X化合物中含有的化学键类型有离子键、共价键.
②反应X+Z→Y的离子方程式为HCO3-+OH-=CO32-+H2O.
③Y的水溶液中离子浓度的大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
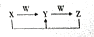 A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图.
A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图. | A | |||||
| B | C | D | |||
| E | |||||
(2)A与C可形成多种10电子微粒,其中分子为NH3,离子为NH4+.
(3)C、D、E的简单离子的半径大小顺序为N3->O2->Na+;
(4)A与C可形成两种常见的化合物,化合物P(相对分子质量为17)和化合物Q(相对分子质量为32).
①写出Q的结构式:
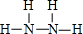
②P的水溶液可作腐蚀剂H2O2的消除剂,其反应物不污染环境,其化学方程式为2NH3.H2O+3H2O2=N2↑+8H2O.
(5)由A、B、C、D、E四种元素中的二种或二种以上元素组成的化合物X、Y、Z、W有如下转化关系:
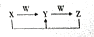 ,其中Y和Z在水溶液中存在的微粒种类相同.
,其中Y和Z在水溶液中存在的微粒种类相同.①X化合物中含有的化学键类型有离子键、共价键.
②反应X+Z→Y的离子方程式为HCO3-+OH-=CO32-+H2O.
③Y的水溶液中离子浓度的大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
15.已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12,下列叙述正确的是( )
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| B. | 向2.0×10-4 mol/L的K2CrO4溶液中加入等体积的2.0×10-4mol/AgNO3溶液后,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中的Cl的物质的量浓度最大 | |
| D. | 将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L的K2CrO4的混合溶液中,则先产生AgCl沉淀. |