题目内容
19.某同学用如图所示装置,通过电解饱和食盐水探究氯气相关性质,其中A、B处的棉花浸有不同溶液.请按要求回答下列问题: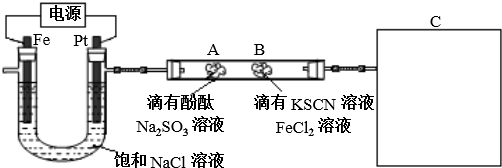
(1)图中Pt电极接电源正(填“正”、“负”)极,此电解总反应的离子反应方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
若在阴极产生448mL气体(标准状况,假设完全从U形管右侧支管导出)后停止实验,测得U形管中溶液的体积为400mL,则常温下此溶液的理论pH=13.
(2)上图实验装置设计存在不足,请在C处方框内画出简图补充完善,并标注必要试剂.
(3)通电一段时间后,可观察到A、B处的棉花颜色均发生变化.
①A处发生反应的离子方程式为Cl2+SO32-+H2O=2Cl-+SO42-+2H+.
②B处先变红,稍后又变为黄色.其中先变红的原因是Fe2+被Cl2氧化产生Fe3+,Fe3+与SCN-反应生成Fe(SCN)3呈红色
(4)该同学为探究B处由红变黄的原因又进行了如下实验:取出B处棉花挤出变黄的溶液样品分为两份,取其中一份于试管X中滴加KSCN溶液,得红色溶液.查资料知SCN-电子式:
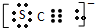 他猜想:SCN-可能被氯水氧化,导致溶液变黄.
他猜想:SCN-可能被氯水氧化,导致溶液变黄.①可能发生的反应为(请配平):SCN-+□Cl2+□H2O=SO42-+NO3-+□+□+CO2当0.5mol SCN-参与反应时转移的电子总数目为8NA.
②设计一简约实验验证此猜想成立:取第二份样品溶液于试管Y中,滴加盐酸、氯化钡溶液;观察有白色沉淀生成,则证明此设想成立.
分析 (1)电解饱和食盐水,在阴极上产生氢气,在阳极上产生氯气,所以阳极是惰性电极,根据电解产物书写电解方程式;
(2)氯气有毒,要用氢氧化钠进行尾气处理;
(3)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,能将氯化亚铁氧化为氯化铁,铁离子遇到硫氰化钾显示红色;
(4)①根据SCN-的电子式为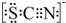 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,根据电子守恒配平SCN-与Cl2反应的化学方程式;
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,根据电子守恒配平SCN-与Cl2反应的化学方程式;
②验证此猜想成立,只要证明硫酸根离子的产生即可,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子.
解答 解:(1)电解饱和食盐水,在阴极上产生氢气,在阳极上产生氯气,所以阳极是惰性电极,即Pt是阳极,金属铁是阴极,Pt电极接电源正极,电解氯化钠的原理方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,若在阴极产生448mL气体,即0.02mol的氢气生成,所以产生氢氧化钠是0.04mol,氢氧化钠的浓度是$\frac{0.04mol}{0.4L}$=0.1mol/L,常温下此溶液的理论pH=13,
故答案为:正;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;13;
(2)氯气有毒,要用氢氧化钠进行尾气处理,C处方框内的图示如下: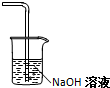 ,故答案为:
,故答案为: ;
;
(3)①氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即Cl2+SO32-+H2O=2Cl-+SO42-+2H+,故答案为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+;
②氯气具有氧化性,能将氯化亚铁氧化为氯化铁,铁离子遇到硫氰化钾显示红色,
故答案为:Fe2+被Cl2氧化产生Fe3+,Fe3+与SCN-反应生成Fe(SCN)3呈红色;
(4)①根据SCN-的电子式为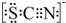 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳的化合价不变,S的化合价从-2价升高到+6价,共升高了8价,N元素的化合价总-3价升高到了+5价,所以共升高了8价,总共升高了16价,氯气具有氧化性,还原产物是氯离子,化合价降低的是Cl元素,所以Cl2的系数是8,Cl-的前边系数是16,根据电荷守恒,产物还需要18H+,根据元素守恒,反应物水的系数是9,即反应的离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;反应转移电子是16mol,当0.5molSCN-参与反应时,转移的电子总数目为8NA,
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳的化合价不变,S的化合价从-2价升高到+6价,共升高了8价,N元素的化合价总-3价升高到了+5价,所以共升高了8价,总共升高了16价,氯气具有氧化性,还原产物是氯离子,化合价降低的是Cl元素,所以Cl2的系数是8,Cl-的前边系数是16,根据电荷守恒,产物还需要18H+,根据元素守恒,反应物水的系数是9,即反应的离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;反应转移电子是16mol,当0.5molSCN-参与反应时,转移的电子总数目为8NA,
故答案为:8、9、16 Cl-、18H+;8NA;
②验证此猜想成立,只要证明硫酸根离子的产生即可,硫酸根离子的检验方法:加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,证明猜想成立,
故答案为:盐酸、氯化钡溶液;白色沉淀.
点评 本题综合考查电解池的工作原理、氯气的性质以及氧化还原反应的配平和离子的检验知识,综合性强,难度不大.

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
| 选项 | 实验操作 | 实验目的 |
| A | 向FeCl3溶液中滴加NaOH溶液 | 制备Fe(OH)3胶体 |
| B | 将CO2通入水玻璃溶液中 | 证明C元素的非金属性大于Si |
| C | 向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤 | 除去苯中混有的苯酚 |
| D | 淀粉与稀H2SO4共热,再加入银氨溶液水浴加热 | 验证淀粉水解产物有无还原性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 离子化合物中不含共价键 | D. | 共价化合物中不含离子键 |
| A. | 2-乙基戊烷 | B. | 1,2-二甲基己烷 | ||
| C. | 2-甲基-4-乙基庚烷 | D. | 2,3-二乙基-4-甲基己烷 |
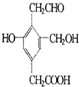 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )| A. | 3:3:2:1 | B. | 6:4:3:2 | C. | 1:1:1:1 | D. | 3:2:2:1 |
| A. | 上述四种氧化物中,至少有三种是碱性氧化物 | |
| B. | 将固体X加入氢氟酸中,X会溶解 | |
| C. | 滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种 | |
| D. | 滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
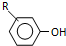 $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$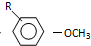 $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$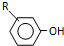
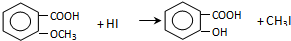 .
.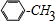 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$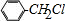 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.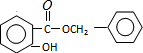 .
. (或
(或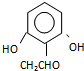 ).
).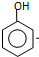 $\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$
$\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$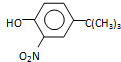 反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为
反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为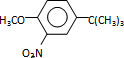 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.