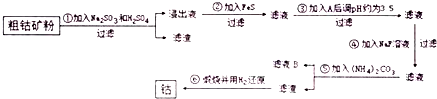
题目内容
18.下列离子方程式中,正确的是( )| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入过量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
分析 A.不符合反应的客观事实,四氧化三铁与硝酸反应生成硝酸铁、一氧化氮和水;
B.醋酸为弱电解质,应保留化学式,硅酸难溶于水,写化学式;
C.不符合反应的客观事实,氨水为弱碱,与氯化铝反应生成氢氧化铝沉淀和氯化铵;
D.氢氧化钙过量,反应生成碳酸钙和氢氧化钠和水.
解答 解:A.Fe3O4溶于足量稀HNO3发生氧化还原反应生成硝酸铁、一氧化氮和水,离子方程式:3Fe3O4+NO3-+28H+=9Fe3++14H2O+NO,故A错误;
B.硅酸钠溶液与醋酸溶液混合,离子方程式:SiO32-+2CH3COOH=H2SiO3↓+2CH3COO-,故B错误;
C.AlCl3溶液中加入过量的氨水反应生成氢氧化铝和氯化铵,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故C错误;
D.向NaHCO3溶液中加入过量Ca(OH)2溶液,反应生成碳酸钙和氢氧化钠和水,离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,题目难度不大,注意反应物用量对反应的影响,选项CD为易错选项.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
8.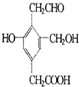 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )| A. | 3:3:2:1 | B. | 6:4:3:2 | C. | 1:1:1:1 | D. | 3:2:2:1 |
9.取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到固体X和滤液Y.下列叙述正确的是( )
| A. | 上述四种氧化物中,至少有三种是碱性氧化物 | |
| B. | 将固体X加入氢氟酸中,X会溶解 | |
| C. | 滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种 | |
| D. | 滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
6.下列有关叙述:①非金属M从化合物中置换出非金属单质N;
②M原子比N原子容易得到电子;
③单质M跟H2反应比N跟H2反应容易得多;
④气态氢化物水溶液的酸性HmM>HnN;
⑤氧化物水化物的酸性HmMOx>HnNOy;
⑥熔点M>N.
能说明非金属元素M比N的非金属性强的是( )
②M原子比N原子容易得到电子;
③单质M跟H2反应比N跟H2反应容易得多;
④气态氢化物水溶液的酸性HmM>HnN;
⑤氧化物水化物的酸性HmMOx>HnNOy;
⑥熔点M>N.
能说明非金属元素M比N的非金属性强的是( )
| A. | ②⑤ | B. | ①②③ | C. | ①②③⑤ | D. | 全部 |
10.C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2.将2.00g C跟16.0g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12L气体(标准状况),生成沉淀的质量为5.00g.下列说法错误的是( )
| A. | 反应后的固体混合物中还含有碳 | |
| B. | 反应后的固体混合物总质量为14.4 g | |
| C. | 反应后的固体混合物中单质Cu的质量为12.8 g | |
| D. | 反应后的固体混合物中氧化物的物质的量为0.05 mol |
7.已知S6、S8的结构如图所示.下列说法中错误的是( )
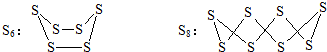
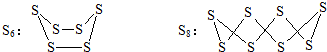
| A. | 硫单质S原子间都以σ键结合 | |
| B. | S6、S8分子中所有S原子都发生了sp3杂化 | |
| C. | S6和S8互为同位素 | |
| D. | 熔点的高低:S8>S6>S4 |
8.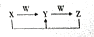 A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图.
A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图.
(1)D的元素符号为O,常用于测定文物年代的同位素是146C.
(2)A与C可形成多种10电子微粒,其中分子为NH3,离子为NH4+.
(3)C、D、E的简单离子的半径大小顺序为N3->O2->Na+;
(4)A与C可形成两种常见的化合物,化合物P(相对分子质量为17)和化合物Q(相对分子质量为32).
①写出Q的结构式: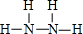
②P的水溶液可作腐蚀剂H2O2的消除剂,其反应物不污染环境,其化学方程式为2NH3.H2O+3H2O2=N2↑+8H2O.
(5)由A、B、C、D、E四种元素中的二种或二种以上元素组成的化合物X、Y、Z、W有如下转化关系: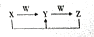 ,其中Y和Z在水溶液中存在的微粒种类相同.
,其中Y和Z在水溶液中存在的微粒种类相同.
①X化合物中含有的化学键类型有离子键、共价键.
②反应X+Z→Y的离子方程式为HCO3-+OH-=CO32-+H2O.
③Y的水溶液中离子浓度的大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
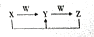 A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图.
A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图. | A | |||||
| B | C | D | |||
| E | |||||
(2)A与C可形成多种10电子微粒,其中分子为NH3,离子为NH4+.
(3)C、D、E的简单离子的半径大小顺序为N3->O2->Na+;
(4)A与C可形成两种常见的化合物,化合物P(相对分子质量为17)和化合物Q(相对分子质量为32).
①写出Q的结构式:
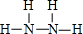
②P的水溶液可作腐蚀剂H2O2的消除剂,其反应物不污染环境,其化学方程式为2NH3.H2O+3H2O2=N2↑+8H2O.
(5)由A、B、C、D、E四种元素中的二种或二种以上元素组成的化合物X、Y、Z、W有如下转化关系:
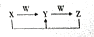 ,其中Y和Z在水溶液中存在的微粒种类相同.
,其中Y和Z在水溶液中存在的微粒种类相同.①X化合物中含有的化学键类型有离子键、共价键.
②反应X+Z→Y的离子方程式为HCO3-+OH-=CO32-+H2O.
③Y的水溶液中离子浓度的大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).