题目内容
【题目】(1)写出符合以下离子方程式的化学方程式:Ba2++SO42-=BaSO4↓________________;
(2)用文字解释明矾净水的原因:______________________________________________;
(3)根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
①用单线桥表示出该反应电子转移的数目和方向_______________________;
②氧化剂是_____________;
③当有34gNH3参加反应时,被氧化的物质的质量为_____g,生成的还原产物的质量为____g。
【答案】BaCl2+ H2SO4= BaSO4↓+2HCl(答案合理即可) 明矾与水反应生成有强吸附性的Al(OH)3胶体 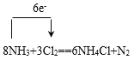 Cl2 8.5 80.25
Cl2 8.5 80.25
【解析】
根据离子方程式的书写规则分析解答;用双线桥法分析氧化还原反应。
(1)书写离子方程式时,强酸、强碱和可溶性盐要写成离子形式,所以符合Ba2++SO42-=BaSO4↓的化学方程式是: BaCl2+ H2SO4= BaSO4↓+2HCl;
(2)明矾与水反应生成有强吸附性的Al(OH)3胶体;
(3)①单线桥可以表示电子转移的数目和方向,从失电子的元素指向得电子的元素: ;
;
②元素化合价降低的反应物是氧化剂,故答案为:Cl2;
③由方程式得,8mol氨气参加反应,2mol氨气被氧化,还原产物为6mol氯化铵,m(NH3)=34g![]() =8.5g;m(NH4Cl)=53.5g/mol
=8.5g;m(NH4Cl)=53.5g/mol![]() =80.25g,故答案为: 8.5;80.25。
=80.25g,故答案为: 8.5;80.25。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目