题目内容
【题目】化学反应原理的发展在化学的发展史上有重要的推动作用。
(1)下图为N2和O2生成NO时的能量变化情况。

则NO分解为N2和O2的反应是 (填“吸热”或“放热”)反应。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,一定条件下发生反应:
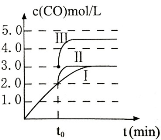
NO2(g)+ CO(g) ![]() CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
①该段时间内,用CO2表示的平均反应率为 。
②下列事实能说明此反应在该条件下已经达到化学平衡的是 (填序号)。
A.容器内气体总质量保持不变 B.NO2的物质的量浓度不再改变
C.NO2的消耗速率与CO2的消耗速率相等 D.容器内气体总物质的量保持不变
(3)锌锰干电池是最早使用的化学电池,其基本构造如下图所示。电路中每通过0.4mol电子,负极质量减少 g;工作时NH4+在正极放电产生两种气体,其中一种气体分子是含10电子的微粒,正极的电极反应式是 。

【答案】(1)放热(2分)
(2)①0.05mol/(L·min)(2分)(不写单位扣1分)
②BC(2分)(单选B或C给1分,错选或多选不给分)
(3)13.0或13(2分)(多写单位扣1分)
2NH4++2e-+2NH3↑+H2↑(2分)。
【解析】
试题分析:(1)由图可知:N≡N键的键能为946kJmol-1,O=O键的键能是497 kJmol-1,则反应热=反应物总键能-生成物总键能=946kJmol-1 +497kJmol-1 -2×632kJmol-1 =180 kJmol-1,该反应的正反应的吸热反应,逆反应必然是放热反应;(2)①v(CO2)=v(NO)= 0.2mol÷2L÷2min=0.05mol/(L·min);②A.该反应是反应前后的物质都是气体,在任何时刻容器内气体的物质的量不变,气体的质量不变,因此不能据此判断反应是否处于平衡状态,错误;B.若NO2的物质的量不变,由于容器的容积不变,则其物质的量浓度不再改变,反应达到平衡状态,正确;C.根据方程式可知任何时刻NO2的消耗速率与CO2的产生速率相等,若NO2的消耗速率与CO2消耗速率相等,则CO2消耗速率等于其产生速率,二氧化碳的浓度不变,反应处于平衡状态,正确;D.该反应是反应前后气体体积相等的反应,在任何时刻容器内气体总物质的量都保持不变,故不能据此判断反应是否处于平衡状态,错误;(3)在锌锰干电池中Zn作负极,碳棒作正极。在负极上Zn失去电子,负极反应为Zn-2e-═Zn2+,根据电极反应式可知负极Zn消耗1mol时转移2mol电子,则每通过0.4mole-,负极质量减少0.2mol×65g/mol=13.0g;NH4+在正极上获得电子而放电产生两种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气,2NH4++2e-+2NH3↑+H2↑。