题目内容
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供艇员呼吸之用,它与二氧化碳反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:
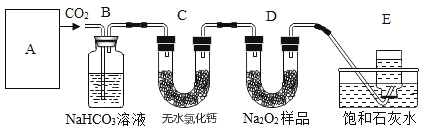
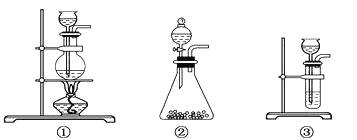
(1)A中制取CO2的装置,应为下列图①、②、③中的图____________;
B装置的作用是________,为了检验E中收集到的气体,在取出集气瓶后,_____________;
(2)若E中的石灰水出现轻微白色浑浊,请说明原因:_________________;
(3)反应完毕时,若测得E中的集气瓶收集到的气体为250 mL,又知氧气的密度为1.43 g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值________(填“大”或“小”)。
【答案】② 吸收A装置中产生的盐酸酸雾 用带火星的木条伸入集气瓶中,木条复燃 D中有部分CO2未参加反应进入E中生成沉淀 小
【解析】
根据实验流程及物质的性质分析选择合适的装置;根据氧气的性质分析检验的方法;根据方程式计算理论生成氧气的质量。
(1)由图示可得制取二氧化碳用大理石和稀盐酸,属于固体和液体反应且反应过程不需要加热,所以选择的装置为②;盐酸易挥发,所以用碳酸氢钠溶液除去;氧气可以助燃,氧气的检验可以用带火星的木条,故答案为:②;吸收A装置中产生的盐酸酸雾;用带火星的木条伸入集气瓶中,木条复燃 ;
(2)使石灰水变浑浊的气体是二氧化碳,故答案为:D中有部分CO2未参加反应进入E中生成沉淀;
(3)收集的氧气质量为:m=0.25L![]() 1.43 g/L=0.3575g,
1.43 g/L=0.3575g,
理论生成氧气的质量为:
2Na2O2+2CO2=2Na2CO3+O2
156 32
1.95g m
m=32![]() 1.95g/156=0.4g,故答案为:小。
1.95g/156=0.4g,故答案为:小。

【题目】锗是一种重要的半导体材料。工业上用精硫锗矿(主要成分为GeS2,杂质不反应)制取Ge,其工艺流程如图所示:

回答下列问题:
(1)开始将精硫锗矿粉碎的目的是______。
(2)高温焙烧精硫锗矿的化学方程式为______。
(3)热还原真空挥发炉内反应的化学方程式为______。
(4)在沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为______(填“10-15”“15-20”或“20-25”),理由是______。
编号 | 加料量(CaCl2/Ge) | 母液体积 (mL) | 过滤后液含锗(mg/L) | 过滤后液 pH | 锗沉淀率(%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
(5)某温度时,沉锗得到的CaGeO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是______。

a.n点与p点对应的Ksp相等
b.通过蒸发可以使溶液由q点变到p点
c.q点无CaGeO3沉淀生成
d.加入Na2GeO3可以使溶液由n点变到m点
(6)CaGeO3与强酸反应可得到H2GeO3。0.l molL-1的NaHGeO3溶液pH_____(填“>”“=”或“<”)7,判断理由是______(通过计算比较)。(25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13。)
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:_________________,该反应是______反应(填放热[或吸热)。
(2)实验结果表明,催化剂的催化效果与_____________________________有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
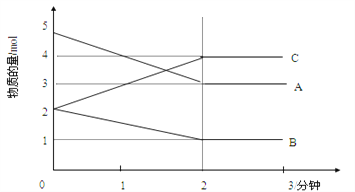
(3)该反应的的化学方程式为_____________________________________________;
(4)反应开始至2分钟时,B的平均反应速率为_____________________________。
(5)能说明该反应已达到平衡状态的是________________________。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,
当改变下列条件时,反应速率会减小的是____。
A.降低温度B.加入催化剂(正)C.增大容器体积
Ⅲ.(7)为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)________________。