题目内容
10.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3.请回答下列问题:(1)Na3N的电子式可表示为
 ,该化合物属于离子化合物.
,该化合物属于离子化合物.(2)Na3N与盐酸反应生成2种盐,它们的电子式分别是
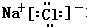 、
、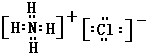 .
.(3)Na3N中两种粒子的半径关系是:Na+< N3-(填“<”、“>”或“=”)
(4)Na3N与水反应的化学方程式为:Na3N+3H2O=3NaOH+NH3↑.
分析 (1)氮化钠为离子化合物,根据离子化合物的电子式书写方法写出其电子式;
(2)根据氮化钠与水的反应,判断氮化钠与盐酸反应产物,写出生成产物的电子式;
(3)具有相同电子层结构的离子,核电荷数与离子半径成反比;
(4)根据原子守恒,判断出氮化钠与与水反应产物,写出反应的化学方程式;
解答 解:(1)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为: ,
,
故答案为: ;离子;
;离子;
(2)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,所以氮化钠和盐酸反应的生成物应该是氯化钠和氯化铵,共计是2种盐,氯化钠和氯化铵都是离子化合物,氯化钠的电子式为: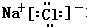 ,氯化铵的电子式为:
,氯化铵的电子式为: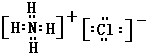 ,
,
故答案为:2;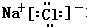 ;
;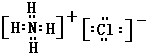 ;
;
(3)Na+与N3-属电子层结构相同的粒子,核电荷数越大半径越小,故Na+的半径小于N3-半径,r(Na+)<r(N3-).
故答案为:<;
(4)Na3N电离出Na+、N3-,H2O电离出H+、OH-,N3-和H+结合成为NH3,Na+与OH-结合成为NaOH,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,
故答案为:Na3N+3H2O=3NaOH+NH3↑.
点评 本题考查化学键的有关判断、化学方程式的书写,题目难度不大,本题是基础性试题的考查,试题基础性强,注重能力的考查,该题有利于巩固学生对教材基础知识的理解,培养学生的规范答题能力,提高学习效率.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列说法中不正确的是( )
| A. | 若XY3分子中X原子处于正三角形的中心,则XY3分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键 | |
| C. | 同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 | |
| D. | 由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键 |
1.下列关于碱金属的描述正确的是( )
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属元素的单质硬度小、密度小、熔点低 | |
| C. | 在空气中加热均可生成多种氧化物 | |
| D. | 碱金属与水反应,均漂浮在水面上 |
18.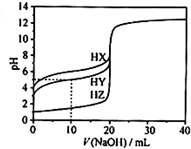 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法不正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法不正确的是( )
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法不正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法不正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | HY与HZ混合,达到平衡时:c(H+)=$\frac{{k}_{2}(HY)•c(HY)}{c({Y}^{-})}$+c(Z-)+c(OH-) |
5.下列分子的电子式书写正确的是( )
| A. | 氨 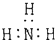 | B. | 四氯化碳 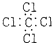 | C. | 氮 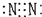 | D. | 二氧化碳 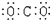 |
15.下列叙述中正确的是( )
| A. | 钠与硫酸铜溶液反应会置换出红色的铜 | |
| B. | 常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 | |
| C. | CO2、NO2、SO2都能与H2O反应,其反应原理相同 | |
| D. | C、N、S三种单质直接与O2反应都能生成两种氧化物 |
2.在标准状况下,mgA气体与ngB气体分子数相等,下列说法不正确的是( )
| A. | 标准状况下,同体积的气体A、B质量比m:n | |
| B. | 25℃时,1Kg气体A与1Kg气体B的分子数之比为n:m | |
| C. | 同温同压下,气体A与气体B的密度之比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
19.下列叙述中正确的是( )
| A. | 发生化学反应时,失去电子越多的金属原子,其还原能力越强 | |
| B. | 目前已发现118种元素,即已发现118种原子 | |
| C. | 核外电子总数相同的粒子,必定是同种元素的原子 | |
| D. | 同一元素的各种同位素的化学性质基本相同 |
20.已知 和
和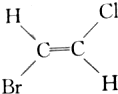 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
 和
和 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |