题目内容
18.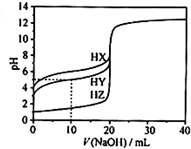 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法不正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法不正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | HY与HZ混合,达到平衡时:c(H+)=$\frac{{k}_{2}(HY)•c(HY)}{c({Y}^{-})}$+c(Z-)+c(OH-) |
分析 A、根据图象分析,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1;
B、根据氢氧化钠滴到10mL,c(HY)≈c(Y-),Ka(HY)≈c(H+);
C、HX恰好完全反应时,HY早已经反应完毕;
D、由于溶液中的c(H+)=c(Y-)+c(Z-)+c(OH-);
解答 解:A、氢氧化钠体积为0时,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,故导电性HZ>HY>HX,故A正确;
B、当NaOH溶液滴到10mL时,溶液中c(HY)≈c(Y-),即Ka(HY)≈c(H+)=10-PH=10-5,故B正确;
C、HX恰好完全反应时,HY早已经完全反应,所得溶液为NaX和NaY混合液,酸性 HX<HY,NaY水解程度小于NaX,故溶液中c(X-)<c(Y-),c(Y-)>c(X-)>c(OH-)>c(H+),故C正确;
D、HY与HZ混合,溶液中电荷守恒为c(H+)=c(Y-)+c(Z-)+c(OH-);再根据HY的电离平衡常数,c(Y-)≠$\frac{{k}_{2}(HY)•c(HY)}{c({Y}^{-})}$,故D错误;
故选D.
点评 本题考查利用中和滴定图象,分析数据,用到了电荷守恒知识,难度中等.

练习册系列答案
相关题目
9.只用一种试剂就能区别NaCl溶液、NaBr溶液、KI溶液、AgNO3溶液,该试剂是( )
| A. | 氯水 | B. | H2O | C. | 稀盐酸 | D. | NaOH溶液 |
6.根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A. | K层电子数为偶数的所有元素所在族的序数与该元素原子的K层电子数相等 | |
| B. | L层电子数为奇数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| C. | L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | M层电子数为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
13.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.回答下列问题:
(1)元素x在周期表中的位置是三周期,IIA族;
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Al(OH)3(填化学式).
(3)气体分子(mn)2的电子式为 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
| m | n | ||
| x | y |
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Al(OH)3(填化学式).
(3)气体分子(mn)2的电子式为
 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
3.X和Y的原子序数都小于两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n-6 |
7.氨水呈弱碱性的原因是( )
| A. | 通常状况下,氨气的溶解度较大 | |
| B. | 氨水中的NH3•H2O电离出少量的OH- | |
| C. | 溶于水的氨气生成的少量NH3•H2O全部电离生成OH- | |
| D. | 氨气本身的碱性弱 |
 Na2O
Na2O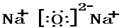 CO2
CO2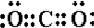 .
. ,该化合物属于离子化合物.
,该化合物属于离子化合物.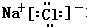 、
、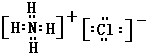 .
.