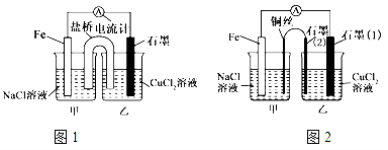
��Ŀ����
����Ŀ�������������ס������������������ص�Ԫ�ء��ش��������⣺
(1)N�Ļ�̬ԭ��������Ӳ���е�ԭ�ӹ����Ϊ______��SO2���ӵ�VSEPRģ��������_________��
(2)N��O��P����Ԫ�ص�һ�������ɴ�С��˳����________����̬�⻯�ﰱ(NH3)���(PH3)�ļ��ǽϴ����_________��
(3)SCN����Cԭ�ӵ��ӻ�����Ϊ______��1 mol SCN���к��м�����ĿΪ______NA��
(4)FeO���۵�____Fe2O3���۵�(���������������=��)����ԭ����________________��
(5)��������������Ҫ�أ�
��ԭ�������������ʾ�����ڲ���ԭ�ӵ����λ�á�������һ�ֳ�Ӳ��ĥ��Ϳ����ϣ��侧���ṹ��ͼ��ʾ������ԭ���������AΪ��0��0��0����BΪ��![]() ��
�� ![]() ��0����DΪ��1��1��1������Cԭ�ӵ��������Ϊ______��
��0����DΪ��1��1��1������Cԭ�ӵ��������Ϊ______��
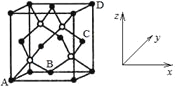
�ھ������������������Ĵ�С����״��Pԭ����Bԭ�ӵ��������Ϊa cm���������ı߳�Ϊ_____cm(�ú�a�Ĵ���ʽ��ʾ)��
���𰸡� 4 ƽ�������� N��O��P NH3 sp 2 �� Fe2+���Ӱ뾶��Fe3+���Ӱ뾶����������٣���FeO�����ܱ�Fe2O3�� (1�� ![]() ��
�� ![]() )
) ![]()
��������(1). N�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ��1s22s22p3��s�ܼ���1��ԭ�ӹ����p�ܼ���3��ԭ�ӹ������N�Ļ�̬ԭ��������Ӳ���е�ԭ�ӹ����Ϊ4��SO2���ӵ�����ԭ�Ӽ۲���Ӷ���Ϊ��2+![]() =3������SO2���ӵ�VSEPRģ��������ƽ�������Σ��ʴ�Ϊ��4��ƽ�������Σ�
=3������SO2���ӵ�VSEPRģ��������ƽ�������Σ��ʴ�Ϊ��4��ƽ�������Σ�
(2). һ������£�Ԫ�صķǽ�����Խǿ����һ������Խ�ǽ�����O��P�����һ��������O��P��ͬһ���ڴ����ң�Ԫ�صĵ�һ�����ܳ��������ƣ�����ԭ�ӵ������p�ܼ����ǰ�������ȶ��ṹ�����һ������N��O������N��O��P����Ԫ�ص�һ�������ɴ�С��˳������N��O��P���縺��N��P������ԭ�ӵĵ縺��Խ�ɼ��Ĺ��õ��Ӷ�������ԭ��Խ�����ɼ��ĵ��Ӷ�֮��ľ���ԽС���ɼ����Ӷ�֮����ų���Խ���¼��DZ������PH3�ļ���С��NH3�ļ��ǣ��ʴ�Ϊ��N��O��P��NH3��
(3). SCN����CO2��Ϊ�ȵ����壬CO2������̼ԭ�Ӽ۲���Ӷ���Ϊ��2+![]() =2��̼ԭ�ӵ��ӻ�����Ϊsp��CO2�ĽṹʽΪ��O=C=O��1mol CO2�к���2mol���������ݵȵ�����ԭ����SCN����Cԭ�ӵ��ӻ�����Ϊsp��1 mol SCN���к���������ĿΪ2NA���ʴ�Ϊ��sp��2��
=2��̼ԭ�ӵ��ӻ�����Ϊsp��CO2�ĽṹʽΪ��O=C=O��1mol CO2�к���2mol���������ݵȵ�����ԭ����SCN����Cԭ�ӵ��ӻ�����Ϊsp��1 mol SCN���к���������ĿΪ2NA���ʴ�Ϊ��sp��2��
(4). ��Fe2+�����Ӱ뾶��Fe3+�����Ӱ뾶��Fe2+������ɱ�Fe3+�٣���FeO�ľ����ܱ�Fe2O3�ľ����ܵͣ�����FeO���۵��Fe2O3���۵�����ʴ�Ϊ������Fe2+���Ӱ뾶��Fe3+���Ӱ뾶����������٣���FeO�����ܱ�Fe2O3����
(5). ��. ԭ���������AΪ��0��0��0����BΪ��![]() ��
�� ![]() ��0����DΪ��1��1��1�����ɾ����ṹʾ��ͼ��֪��C ԭ��λ�ھ��������ģ�Cԭ����x��Ϊ1����y��z�Ͼ�Ϊ
��0����DΪ��1��1��1�����ɾ����ṹʾ��ͼ��֪��C ԭ��λ�ھ��������ģ�Cԭ����x��Ϊ1����y��z�Ͼ�Ϊ![]() ����Cԭ�ӵ��������Ϊ(1��
����Cԭ�ӵ��������Ϊ(1�� ![]() ��
�� ![]() )���ʴ�Ϊ��(1��
)���ʴ�Ϊ��(1�� ![]() ��
�� ![]() )��
)��
��. �ɾ����ṹʾ��ͼ��֪��Pԭ������Χ��4��Bԭ�Ӿ���������γ���������ṹ��Pԭ����Bԭ�ӵ��������Ϊa cm�������弸��֪ʶ��֪�������ı߳�Ϊ�� ![]() ��a cm=
��a cm= ![]() cm���ʴ�Ϊ��
cm���ʴ�Ϊ�� ![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���±���A��B�����л�����й���Ϣ��
A | B |
������ģ��Ϊ�� ����ʹ������Ȼ�̼��Һ��ɫ�� ��������Ǻ���ʯ�ͻ���ˮƽ�ı�־�� | ����C��H��O����Ԫ����ɣ��dz����еij�����ζ���� ��ˮ��Һ��ʹ��ɫʯ����Һ��졣 |
���ݱ�����Ϣ�ش��������⣺
(1)����A������˵���У�����ȷ����__________(����)��
a�������ﺬ��̼̼˫�� b�����������е�ԭ�ӹ�ƽ�� c���ṹ��ʽΪCH2-CH2
(2)A��H2�����ӳɷ�Ӧ������X����X�ڷ�����ɺͽṹ�����Ƶ��л�����һ���࣬���ǵ�ͨʽΪCnH2n+2����n=_________ʱ�������ǻ��↑ʼ����ͬ���칹�ݡ�
(3)B���Ҵ���Ӧ�Ļ�ѧ����ʽΪ_____________����Ӧ����Ϊ_______________��
(4)��AΪԭ�Ͽ�ֱ������һ�ָ߷��ӻ�����P����P�Ľṹ��ʽΪ_______________��