题目内容
【题目】氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=___。
(2)工业合成氨气的反应为N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
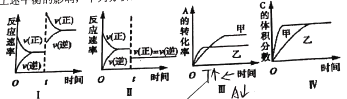
(3)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是___。

其中表示平衡混合物中NH3的含量最高的一段时间是___。
(4)温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的化学平衡常数的为___。
【答案】- 92.4kJ/mol ①② 增大压强 t2-t3 ![]()
【解析】
(1)①已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1;②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ·mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1;
则N2(g)+3H2(g)=2NH3(g)可以是①+③×![]() -②×
-②×![]() 得到,热量也进行相应的计算;
得到,热量也进行相应的计算;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,根据影响化学平衡移动的因素以及影响化学平衡常数的因素来回答;
(3)根据图象分析影响平衡的因素,主要是反应进行方向和速率的变化特征分析;
(4)根据方程式计算出平衡时的各物质的物质的量浓度,再根据平衡常数表达式计算出平衡常数。
(1) ①已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1;
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ·mol-1;
③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1;
则N2(g)+3H2(g)=2NH3(g)可以是①+③×![]() -②×
-②×![]() 得到,所以该反应的△H = 180.5kJ/mol+ (- 483.6kJ/mol)×
得到,所以该反应的△H = 180.5kJ/mol+ (- 483.6kJ/mol)×![]() -(-905kJ/mol)×
-(-905kJ/mol)×![]() =- 92.4kJ/mol
=- 92.4kJ/mol
故答案为:- 92.4kJ/mol;
(2)、平衡常数只与温度有关,催化剂不能改变平衡状态,增大反应物浓度化学平衡正向移动,增大压强,化学平衡向着气体系数和减小的方向移动,
故答案为:①②;
(3)、N2(g)+3H2(g)=2NH3(g)△H= - 92.4kJ/mol;反应是放热反应,反应前后气体体积减小,
由反应速率与时间关系图象可知,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,所以氨气的百分含量是减小的, 即表示平衡混合物中NH3的含量最高的一段时间是t2-t3;
故答案为:增大压强;t2-t3;
(4)、 N2(g)+3H2(g)=2NH3(g)
开始mol/L 2a 4a 0
变化mol/L a 3a 2a
平衡mol/L a a 2a
则 ;
;
故答案为:![]() 。
。

【题目】下列实验操作和现象能得出正确结论的是![]()
![]()
选项 | 实验操作 | 现象 | 结论 |
A | 向淀粉 | 溶液变蓝 | 达到滴定终点 |
B | 将 | 品红溶液颜色不褪色 |
|
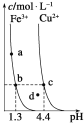
C | 向浓度均为 | 先产生红褐色沉淀 | 相同温度下, |
D | 向饱和纯碱溶液中通入 | 产生白色沉淀 | 小苏打属于难溶物 |
A.AB.BC.CD.D