题目内容
【题目】硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)═2SO3(g)△H<0
(1)如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为___。
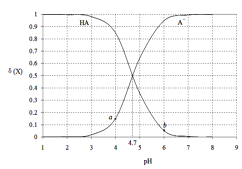
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示。根据图示回答下列问题:

该反应的平衡常数的表达式为___,平衡状态由A变到B时,平衡常数K(A)___K(B)(填“>”、“<”或“=”)。
(3)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是___;若增大压强时,反应速度变化情况画在c~d处___。
【答案】1mol/(Lmin)  = 升温 减小SO3浓度
= 升温 减小SO3浓度 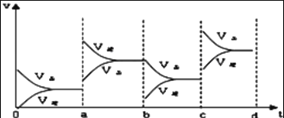
【解析】
(1)、根据![]() 和化学反应速率之比等于化学计量数之比进行计算,得出正确结论;
和化学反应速率之比等于化学计量数之比进行计算,得出正确结论;
(2)、化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,温度不变,则平衡常数K不变;
(3)、根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然減小的特点。
(1)、![]() ,v(O2) : v (SO2) =1: 2,v(O2) =0.5v(SO2) =1mol/(Lmin);
,v(O2) : v (SO2) =1: 2,v(O2) =0.5v(SO2) =1mol/(Lmin);
故答案为:1mol/(Lmin);
(2)、化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故可逆反应2SO2(g)+O2(g)═2SO3(g)的平衡常 数 ,平衡常数只受温度的影响,温度不变,则压强改变,平衡状态由A变到B时,则K(A)=K(B);
,平衡常数只受温度的影响,温度不变,则压强改变,平衡状态由A变到B时,则K(A)=K(B);
故答案为: ;=;
;=;
(3)、 a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强,则正逆反应速率均增大,且反应向正反应方向进行;
故答案为:升温;减小SO3浓度; 。
。

 名校课堂系列答案
名校课堂系列答案【题目】已知![]() 时,几种难溶电解质的溶度积常数
时,几种难溶电解质的溶度积常数![]() 如表所示:
如表所示:
难溶电解质 | AgCl | AgBr | AgI |
|
|
Ksp |
|
|
|
|
|
下列叙述正确的是
A.溶度积常数越小该物质的溶解性一定越小
B.将浓度均为![]()
![]() 的
的![]() 溶液和
溶液和![]() 溶液等体积混合,有
溶液等体积混合,有![]() 沉淀生成
沉淀生成
C.向AgCl的悬浊液中滴加饱和NaI溶液不能得到黄色AgI
D.向100![]()
![]() 的
的![]() 溶液中加入等体积等物质的量浓度的
溶液中加入等体积等物质的量浓度的![]() 溶液,有白色沉淀生成
溶液,有白色沉淀生成