题目内容
9. 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
步骤二:碱式碳酸铜的制备向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品.
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)上图装置中NaOH的作用是吸收氮氧化物.
(3)步骤二中,洗涤的目的是洗涤除去碱式碳酸铜表面附着的硝酸钠.
(4)步骤二的滤液中可能含有CO32-,检验CO32-的方法取滤液少许于试管中,向其中滴加稀盐酸,振荡,将产生的无色无味的气体通入澄清石灰水中,若石灰水变浑浊,则滤液中含有CO32-.
(5)若实验得到2.42g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80g固体,此样品中碱式碳酸铜的质量分数是91.7%.(保留三位有效数字)
分析 (1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染;
(3)碱式碳酸铜表面附着的硝酸钠,需要洗涤除去;
(4)利用碳酸根与酸反应生成气体,将生成的气体通过澄清的石灰水进行检验;
(5)碱式碳酸铜完全分解得到CuO,令样品中碱式碳酸铜的质量分数为x,则碱式碳酸铜的质量为2.42x g,根据碱式碳酸铜分解方程式,利用差量法列方程计算.
解答 解:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染,所以装置中NaOH的作用是吸收氮氧化物,故答案为:吸收氮氧化物;
(3)洗涤除去碱式碳酸铜表面附着的硝酸钠,
故答案为:洗涤除去碱式碳酸铜表面附着的硝酸钠;
(4)检验碳酸根的方法为:取样,加入盐酸,将生成的气体通入澄清的石灰水,溶液变浑浊,说明含有CO32-,
故答案为:取滤液少许于试管中,向其中滴加稀盐酸,振荡,将产生的无色无味的气体通入澄清石灰水中,若石灰水变浑浊,则滤液中含有CO32-;
(5)令样品中碱式碳酸铜的质量分数为x,碱式碳酸铜的质量为2.42x g,则:
Cu2(OH)2CO3△_2CuO+H2O+CO2↑ 质量减少
222 62
2.42x g 2.42g-1.8g=0.62g
所以,222:62=2.42x g:0.62g
解得x=91.7%
故答案为:91.7%.
点评 本题考查物质制备实验,综合考查学生的实验能力,需要学生具备扎实的基础,难度中等.

| A. | 正反应生成的NH3速率和逆反应生成N2的速率相等 | |
| B. | 反应器中压强不随时间变化而变化 | |
| C. | 1molN≡N键断裂的同时,有6molN-H键断裂 | |
| D. | 混合气体平均分子量保持不变 |
| A. | c(NO2) | B. | c(N2O4) | C. | c(NO2)c(N2O4) | D. | c(N2O4)c2(NO2) |
| A. | a的值为3 | B. | 平衡时X的浓度为0.8mol/L | ||
| C. | Y的转化率为60% | D. | 反应速率v(Y)=0.2mol/(L•min) |
| A. | 2A+3B=2C | B. | A+3B=2C | C. | 3A+B=2C | D. | A+B=C |
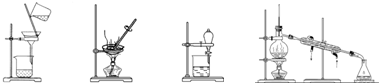
| A. | 蒸发、蒸馏、过滤、萃取 | B. | 过滤、蒸馏、蒸发、萃取 | ||
| C. | 过滤、蒸发、分液、蒸馏 | D. | 萃取、蒸馏、蒸发、过滤 |
 硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为:
硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为: .
.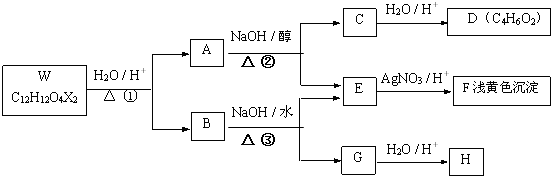

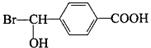
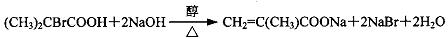
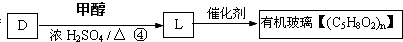 ,反应④的化学方程式是
,反应④的化学方程式是
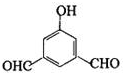 、
、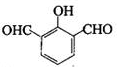 、
、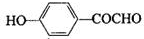 .
.