题目内容
11.将50mL 物质的量浓度为12mol/L的盐酸(密度为1.19g/cm3)稀释成6mol/L的盐酸(密度为1.10g/cm3),需加水(密度为4℃时的测量值)的体积为( )| A. | 50mL | B. | 50.5mL | C. | 55mL | D. | 59.5mL |
分析 根据稀释过程中溶质的物质的量不变计算出稀释后溶液体积;然后利用质量守恒定律计算出需要加入水的质量,最后根据4℃时水的密度为1g/mL计算出需要加入水的体积.
解答 解:稀释过程中溶质的物质的量不变,则稀释后溶液体积为:$\frac{12mol/L×0.05L}{6mol/L}$=0.1L=100mL,
稀释前溶液质量为:1.19g/cm3×50mL=59.5g,
稀释后溶液质量为:1.10g/cm3×100mL=110g,
所以需要加入水的质量为:110g-59.5g=50.5g,
密度为4℃时水的密度为1g/mL,则需要加入水的体积为:$\frac{50.5g}{1g/mL}$=50.5mL,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握质量守恒定律在化学计算中的应用方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.生活中处处存在化学,下列说法不正确的是( )
| A. | 聚乳酸可用作手术缝合纱线、缓释药物材料 | |
| B. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| C. | 福尔马林用于标本的制作是利用了使蛋白质变性的性质 | |
| D. | 在清理厕所时洁厕灵和84消毒液不能混用,否则可能发生中毒现象 |
2.下列是有关外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )
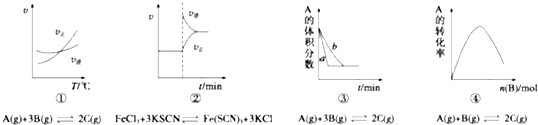

| A. | ①是其他条件一定时,反应速率随温度变化的图象,则正反应△H>0 | |
| B. | ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图象 | |
| C. | ③是在有无催化剂存在条件下,建立平衡过程的图象,b是使用催化剂时的曲线 | |
| D. | ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图象 |
6.下列有关硅和硅的化合物的叙述中正确的是( )
| A. | 二氧化硅是良好的半导体材料,可用于制造集成电路、晶体管器件和硅芯片等 | |
| B. | 硅的化学性质很稳定,常温下与酸、碱、盐等难以反应 | |
| C. | 硅酸俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 向含有少量酚酞的硅酸钠溶液中逐滴加入稀盐酸,边加边振荡,可以看到溶液红色逐渐消失 |
20. 如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
 如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )| A. | ①加入的是CCl4,②加汽油,③加酒精 | B. | ①加入的是汽油,②加CCl4,③加酒精 | ||
| C. | ①加入的是汽油,②加酒精,③加CCl4 | D. | ①加入的是酒精,②加CCl4,③加汽油 |
 苯甲酸和苯甲酸钠均是食品防腐剂.某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应.
苯甲酸和苯甲酸钠均是食品防腐剂.某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应.
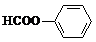 +2NaOH-→HCOONa+
+2NaOH-→HCOONa+ +H2O.
+H2O.