题目内容
8.在能使酚酞变红的无色溶液中,能大量共存的离子组是( )| A. | Na+、Mg2+、Br-、Ba2+ | B. | Na+、SO32-、SO42-、K+ | ||
| C. | K+、MnO4-、NO3-、Na+ | D. | K+、Ca2+、SO32-、Cl- |
分析 能使酚酞试液变红色的溶液中含有氢氧根离子,溶液无色,说明不含有色离子,离子之间不反应生成气体、沉淀、弱电解质和发生氧化还原反应、络合反应及双水解反应的能大量共存.
解答 解:A.碱性条件下Mg2+不能大量共存,故A错误;
B.碱性条件下离子之间不发生任何反应,可大量共存,故B正确;
C.MnO4-有颜色,与题目无色不符,故C错误;
D.Ca2+、SO32-反应生成沉淀,不能大量共存,故D错误.
故选B.
点评 本题考查离子共存,为高频考点,明确离子共存条件及离子性质是解本题关键,注意结合限制性条件分析解答,侧重考查复分解反应,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
18.研究人员研制利用软锰矿浆(主要成分是MnO2)吸收流酸厂的尾气SO2,制备流酸锰的生产流程如下:
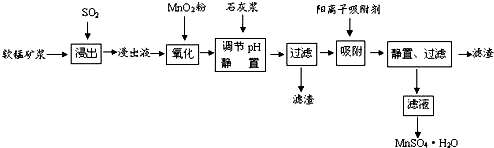
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.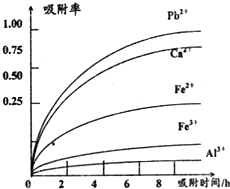
请回答下列问题:
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.

| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.
19.0.1mol两种气态烃组成的混合气体完全燃烧,得到0.16mol CO2和3.6g水.下列说法不正确的是( )
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烯 | ||
| C. | 混合气体中一定没有乙烷 | D. | 混合气体中一定有乙炔 |
16.下列离方程式书写正确的是( )
| A. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| B. | NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O | |
| C. | MnO2与浓盐酸制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4+ |
3.把一黄豆粒大小的金属钠投入盛有CuSO4溶液的烧杯里,不可能观察到的现象是( )
| A. | 钠熔化,浮在液面上四处游动 | B. | 有气体产生 | ||
| C. | 溶液中产生蓝色絮状沉淀 | D. | 溶液中析出红色的铜 |
13.分子晶体中如果不是由于分子本身形状的影响,它的晶体将取密堆积结构,原因是分子晶体中( )
| A. | 分子间作用力无一定方向性 | B. | 占据晶格结点的微粒是原子 | ||
| C. | 化学键是共价键 | D. | 三者都是 |
20.下列物质的性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 酸性强弱:HClO4>HBrO4>HIO4 | ||
| C. | 碱性强弱:Ba(OH)2>Sr(OH)2>Ca(OH)2 | D. | 非金属性强弱:Cl>Se>Br |
17.有机化学与生活密切相关,下列有关说法不正确的是( )
| A. | 苯酚不慎粘在皮肤上可用酒精洗涤 | |
| B. | 福尔马林是混合物 | |
| C. | 工业酒精只能作实验室燃料 | |
| D. | 服用豆浆或鸡蛋清可以缓解铜离子中毒 |