题目内容
3.把一黄豆粒大小的金属钠投入盛有CuSO4溶液的烧杯里,不可能观察到的现象是( )| A. | 钠熔化,浮在液面上四处游动 | B. | 有气体产生 | ||
| C. | 溶液中产生蓝色絮状沉淀 | D. | 溶液中析出红色的铜 |
分析 钠的密度小于水,熔点低,钠与硫酸铜溶液反应实质是钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,据此解答.
解答 解:钠的密度小于水,熔点低,钠与硫酸铜溶液反应实质是钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,所以看到的现象为:钠熔化,浮在液面上四处游动,有气体生成,有蓝色沉淀生成,不会产生铜;
故选:D.
点评 本题考查了钠与盐溶液的反应,熟悉钠的活泼性是解题关键,注意反应顺序,题目难度不大.

练习册系列答案
相关题目
13.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2在曲颈瓶中模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
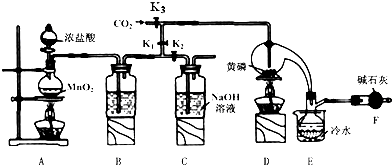
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3.PCl3、POCl3的熔沸点如表:
请回答下列问题:
(1)B中所装试剂是浓H2SO4;E中冷水的作用是冷凝PCl3防止其挥发.
(2)F中碱石灰的作用是吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应.
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POC13、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,
根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为79.75%.

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3.PCl3、POCl3的熔沸点如表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是浓H2SO4;E中冷水的作用是冷凝PCl3防止其挥发.
(2)F中碱石灰的作用是吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应.
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POC13、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,
根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为79.75%.
14.下列各组混合物,可以用分液漏斗分离的是( )
| A. | 甲苯和酒精 | B. | 甲苯和苯 | C. | 溴乙烷与水 | D. | 苯与溴乙烷 |
11.下列物质中,其水溶液能导电,但属于非电解质的是( )
| A. | 硫酸 | B. | Cl2 | C. | NH4NO3 | D. | NH3 |
8.在能使酚酞变红的无色溶液中,能大量共存的离子组是( )
| A. | Na+、Mg2+、Br-、Ba2+ | B. | Na+、SO32-、SO42-、K+ | ||
| C. | K+、MnO4-、NO3-、Na+ | D. | K+、Ca2+、SO32-、Cl- |
15.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性.下列有关分析正确的是( )
| A. | K3C60中只有离子键 | B. | K3C60中碳元素显-3价 | ||
| C. | C60与12C互为同素异形体 | D. | 该晶体在熔融状态下能导电 |
12.质量相等的SO2和SO3,所含氧原子数之比为( )
| A. | 1:1 | B. | 2:3 | C. | 6:5 | D. | 5:6 |
 .
.