题目内容
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是
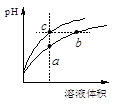
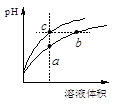
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三点溶液水的电离程度a>b>c |
| D.与等体积b、c处溶液反应,消耗等量的NaOH |
C
试题分析:盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液的。A、溶液的导电能力和溶液中自由移动离子的多少有关,当溶液的体积相等时,a、c两点溶液的离子浓度不一样,所以导电能力不一样,故A错误;B、b点溶液中,根据质子守恒,得出c(OH-)+c(NH3·H2O)=c(H+),故B错误;C、盐酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH<b点的pH,说明a点酸性大于b点酸性、a点氢离子大于b点氢离子,所以a、b二点溶液水的电离程度a>b,综上所述a、b、c三点溶液水的电离程度a>b>c,故C正确;D、用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb<Vc,故D错误,答案选C。

练习册系列答案
相关题目


 )>c(C
)>c(C  )>c( H2CO3)
)>c( H2CO3)
 HSO3ˉ+OHˉ,下列说法正确的是
HSO3ˉ+OHˉ,下列说法正确的是