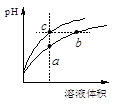题目内容
水的电离平衡曲线如图所示。下列说法错误的是


| A.水的电离常数KW数值大小关系为:b>c>d |
| B.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- |
| C.温度不变,加入少量NaOH可使溶液从c点变到 a点 |
| D.在b点对应温度下,将pH=2的HCl与pH=10的NaOH溶液等体积混合后,溶液显中性 |
BC
试题分析:A、依据图象分析可知,b点Kw=10-12,c点Kw=10-13,d点Kw=10-14,所以b>c>d,故A正确;B、a点是常温下的溶液,氢氧根离子浓度和氢离子浓度相等,溶液呈中性,a点对应的溶液中大量存在Na+、Cl-、SO42-,但Fe3+水解显酸性,不符合溶液中性,故B错误;C、温度不变加入氢氧化钠溶液Kw不变,c、a点是不同温度下的溶液,故C错误;D、b点Kw=10-12,中性溶液pH=6;将pH=2的HCl与pH=10的NaOH溶液等体积混合后,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,故D正确,答案选BC。

练习册系列答案
相关题目
 mol/L
mol/L