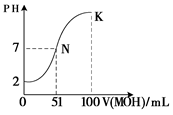
题目内容
常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
| A.将①与②分别稀释相同倍数后溶液的pH:①>② |
| B.③与④中已电离的水分子的数目相等 |
| C.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O) |
| D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
C
试题解析:醋酸、盐酸物质的量浓度相同时,醋酸电离度较小,盐酸完全电离,醋酸的pH大于盐酸,稀释相同倍数后,醋酸的pH仍大于盐酸,A错;氨水抑制水的电离,CH3COONa水解促进水的电离,二者溶液中已电离的水分子数不等,B错;醋酸、氨水等体积、等物质的量浓度混合后溶液呈中性,说明CH3COO-、NH4+的水解程度相同,则Ka(CH3COOH)与Kb(NH3·H2O)相等,C正确;醋酸和CH3COONa溶液混合,醋酸会抑制CH3COO-的水解,同时醋酸电离使溶液显酸性,根据物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+),和电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),可得关系式:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),溶液显酸性则c(H+)> c(OH-),故c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),D错。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
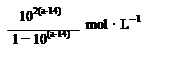
 mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据: