��Ŀ����
����Ŀ���ı�0.1molL��1��Ԫ����H2A��Һ��pH����Һ�е�H2A��HA����A2�������ʵ���������(x)��pH�ı仯��ͼ��ʾ[��֪����x��=c(x)/(c(H2A)+c(HA��)+c(A2��)])������������ȷ����

A. Ka2��H2A����������Ϊ10-4
B. NaHA��Һ�У�HA����ˮ������С��HA���ĵ�������
C. �ں�H2A��HA����A2������Һ�У���������NaOH���壬��(HA��)һ������
D. �������ʵ�����NaHA��Na2A���������ˮ�����õ���Һ����(HA��)����(A2��)
���𰸡�B
��������A��pH=4.2ʱ��c(H+)=10-4.2mol/L��c(HA��)��c(A2��)��Ka2=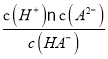 = 10-4.2mol/L��������Ϊ10-5��ѡ��A����B������ͼ�����߿�֪����pH��2��3֮��ʱc(HA��)�ϴ�������NaHAΪ������NaHA��Һ�����ԣ�֤��HA����ˮ������С��HA���ĵ���������ѡ��B��ȷ��C���ں�H2A��HA����A2������Һ�У���������NaOH���壬ʹƽ��HA��
= 10-4.2mol/L��������Ϊ10-5��ѡ��A����B������ͼ�����߿�֪����pH��2��3֮��ʱc(HA��)�ϴ�������NaHAΪ������NaHA��Һ�����ԣ�֤��HA����ˮ������С��HA���ĵ���������ѡ��B��ȷ��C���ں�H2A��HA����A2������Һ�У���������NaOH���壬ʹƽ��HA��![]() H+(aq)+A2-�����ƶ���c(HA��)��С����(HA��)=
H+(aq)+A2-�����ƶ���c(HA��)��С����(HA��)= 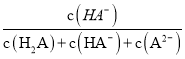 =
=![]() ��С��ѡ��C����D����ͼ���֪��HA-��A2-���ʱ��Һ�����ԣ���HA-�ĵ���̶ȴ���A2-��ˮ��̶ȣ����Ե��������ʵ�����NaHA��Na2A���������ˮʱ����(HA��)<��(A2��)��ѡ��D����ѡB��
��С��ѡ��C����D����ͼ���֪��HA-��A2-���ʱ��Һ�����ԣ���HA-�ĵ���̶ȴ���A2-��ˮ��̶ȣ����Ե��������ʵ�����NaHA��Na2A���������ˮʱ����(HA��)<��(A2��)��ѡ��D����ѡB��

����Ŀ�����и��������У�����X������Yͬʱͨ�� ʢ����ҺZ��ϴ��ƿ�У���ͼ����һ��û�г������ɵ���( )
X | Y | Z |
| |
A | NO2 | SO2 | BaCl2 | |
B | CO2 | SO2 | CaCl2 | |
C | NH3 | CO2 | BaCl2 | |
D | NH3 | CO2 | Al2(SO4)3 |
A. A B. B C. C D. D

