题目内容
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 能使KSCN试液变红的溶液中:H+、Zn2+、SO32-、SO42- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 显强碱性的溶液中:K+、Na+、AlO2-、CO32- |
分析 A.使酚酞变红色的溶液,显碱性;
B.能使KSCN试液变红的溶液,含铁离子;
C.与Al反应能放出H2的溶液,为非氧化性酸或强碱溶液;
D.显强碱性的溶液,该组离子之间不反应.
解答 解:A.使酚酞变红色的溶液,显碱性,不能大量存在Al3+,故A错误;
B.能使KSCN试液变红的溶液,含铁离子,与SO32-发生氧化还原反应,且SO32-、H+结合生成水和气体,不能大量共存,故B错误;
C.与Al反应能放出H2的溶液,为非氧化性酸或强碱溶液,H+、Fe2+、NO3-发生氧化还原反应,碱性溶液中不能大量存在Fe2+,故C错误;
D.显强碱性的溶液,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
11.下列化合物中一定不含离子键的是( )
| A. | NaOH | B. | K2CO3 | C. | Na2O | D. | H2SO4 |
12.下列变化的实质相似的是( )
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使品红溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁制容器存放、加热条件下浓硫酸能与木炭反应
⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
⑦二氧化碳、二氧化硫使澄清石灰水变浑浊.
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使品红溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁制容器存放、加热条件下浓硫酸能与木炭反应
⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
⑦二氧化碳、二氧化硫使澄清石灰水变浑浊.
| A. | 只有②③④ | B. | 只有⑤⑦ | C. | 只有③④⑥⑦ | D. | 全部 |
9.下列图示中关于铜电极的连接错误的是( )
| A. | 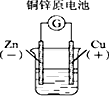 稀硫酸 | B. | 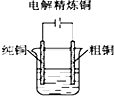 硫酸铜溶液 | C. | 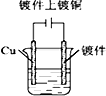 硫酸铜溶液 | D. | 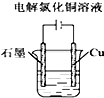 氯化铜溶液 |
6.请分析、比较以下几组化学反应,得出结论.
| 组别 | 化学方程式 | 结论 |
| I | 6CO2+6H2O═C6H12O6+6O2 CO2+H2O═H2CO3 | 反应物相同,生成物不同, 原因反应条件不同. |
| Ⅱ | Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | 反应物相同,生成物不同, 原因反应物的浓度不同. |
| Ⅲ | C+O2(充足)$\frac{\underline{\;点燃\;}}{\;}$CO2 2C+O2(不充足)$\frac{\underline{\;点燃\;}}{\;}$2CO | 反应物相同,生成物不同, 原因反应物的量不同. |
| Ⅳ | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑(反应缓慢) 2KClO3 $→_{加热}^{二氧化锰}$2KCl+3O2↑(反应迅速) | 反应物相同,反应速率不同, 原因有无催化剂. |
| 实践与应用 | 科学探究正努力实现对化学反应的控制,很多化学家致力于研究二氧化碳的“组合转化”技术,把过多二氧化碳转化为有益于人类的物质.若让二氧化碳和氢气在一定条件下反应,可生成一种重要的化工原料,反应的化学方程式如下: 2CO2+6H2$\frac{\underline{\;催化剂\;}}{△}$X+4H2O,推断X的化学式是C2H4. | |
10.砷为33号元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
| A. | 砷在通常情况下是固体 | B. | 砷的还原性比磷弱 | ||
| C. | 可以存在-3、+3、+5等多种化合价 | D. | As2O5对应水化物的酸性比H3PO4弱 |
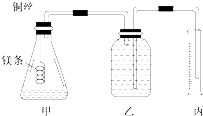 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下: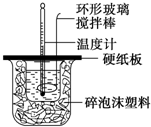 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: