题目内容
16.氯元素是生产生活中常见的非金属元素.(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式Cl2+2OH-=ClO-+Cl-+H2O;不直接用Cl2作漂白剂的原因是Cl2的溶解度不大,生成的HClO不稳定且难以保存,使用起来不方便(写出两条).
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物.下列物质中可以替代Cl2为自来水杀菌消毒的是ad(填字母序号).
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀.
①NaCl和Cl2中化学键的类型分别是离子键和共价键.
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2.若生成Cl2 22.4L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是2NaCl+SO2+O2$\frac{\underline{\;加热\;}}{\;}$Na2SO4+Cl2.
③已知:
2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2.依据上述已知反应,写出该反应的热化学方程式:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol.
分析 (1)氯气与氢氧化钠反应生成氯化钠、次氯酸与水;Cl2的溶解度不大,生成的HClO不稳定且难以保存,使用起来不方便等,不直接用Cl2作漂白剂;
(2)替代Cl2为自来水杀菌消毒的物质应具有强氧化性;
(3)①NaCl属于离子化合物,含有离子键,Cl2中氯原子之间形成共价键;
②由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,配平书写化学方程式;
③发生反应:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),
已知:①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
根据盖斯定律,①×$\frac{1}{2}$+③-②可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),反应热也进行相应的计算,进而书写热化学方程式.
解答 解:(1)氯气与氢氧化钠反应生成氯化钠、次氯酸与水,反应离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,应用Cl2的溶解度不大,生成的HClO不稳定且难以保存,使用起来不方便等,不直接用Cl2作漂白剂,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;Cl2的溶解度不大,生成的HClO不稳定且难以保存,使用起来不方便;
(2)替代Cl2为自来水杀菌消毒的物质应具有强氧化性,可以用臭氧、ClO2代替,氨气不能杀菌消毒、硫酸铝可以除去悬浮物质,不能杀菌消毒,故选:ad;
(3)①NaCl属于离子化合物,含有离子键,Cl2中氯原子之间形成共价键,故答案为:离子键;共价键;
②由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,反应化学方程式为:2NaCl+SO2+O2$\frac{\underline{\;加热\;}}{\;}$Na2SO4+Cl2,故答案为:2NaCl+SO2+O2$\frac{\underline{\;加热\;}}{\;}$Na2SO4+Cl2;
③发生反应:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),
已知:①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
根据盖斯定律,①×$\frac{1}{2}$+③-②可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),△H=(-196.46kJ•mol-1)×$\frac{1}{2}$+(-184.60kJ•mol-1)-(-285.84kJ•mol-1)=+3.01kJ•mol-1,故热化学方程式为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol,
故答案为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol.
点评 本题考查氯气性质、化学键、方程式书写、盖斯定律应用等,难度不大,侧重考查学生对知识的迁移应用.

| A. | Fe3+ (Al3+),加过量的氨水,过滤 | |
| B. | KCl溶液(BaCl2),加入足量的K2SO4溶液,过滤 | |
| C. | CO2 (SO2),将混合气体通过依次饱和碳酸氢钠溶液和浓硫酸,洗气 | |
| D. | NaHCO3溶液(Na2CO3溶液):加入适量的Ca(OH)2溶液,过滤 |
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
| A. | H2N-CH2-COOH既能与盐酸反应、又能与氢氧化钠溶液反应 | |
| B. | 油脂是高级脂肪酸甘油酯,均不能发生氢化反应 | |
| C. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| D. | 合成橡胶 的单体之一是2-丁炔 的单体之一是2-丁炔 |
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 能使KSCN试液变红的溶液中:H+、Zn2+、SO32-、SO42- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 显强碱性的溶液中:K+、Na+、AlO2-、CO32- |

| A. | 可以用有机溶剂萃取 | |
| B. | 可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
| A. | v(A)=0.4mol/(L•s) | B. | v(B)=0.8mol/(L•s) | C. | v(C)=1.2mol/(L•s) | D. | v(D)=0.7mol/(L•s) |
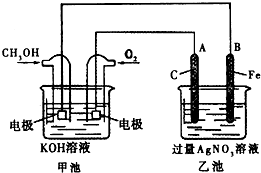 据报道,摩托罗拉公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{放电}^{充电}$K2CO3+6H2O
据报道,摩托罗拉公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{放电}^{充电}$K2CO3+6H2O